
- •Химия как раздел естествознания. Материя. Вещество. Поле.
- •2. Основные классы неорганических соединений.
- •3. Основные понятия и законы химии. Закон эквивалентов.
- •4. Строение атомов и периодическая система элементов.
- •5. Химическая связь.
- •6. Раствор.
- •7. Комплексные соединения.
- •8. Ионные уравнения реакций. Гидролиз солей.
- •9. Скорость химической реакции.
- •10. Окислительно-восстановительные реакции.
- •11. Гальванический элемент.
- •12. Электролиз.
- •13. Коррозия металлов.
- •Оглавление
Химия как раздел естествознания. Материя. Вещество. Поле.
Естествознание – система наук о природе.
Химия – наука, изучающая превращения веществ, их состав и свойства.
Основные учения:
-
О направлении химических процессов (термодинамика).
-
О скорости химических процессов (кинетика).
-
О строении вещества.
-
О периодическом изменении свойств элементов и их соединений.
Задачи химии:
-
Получение максимального количества требуемого вещества с минимальным расходом исходных веществ и минимальными затратами энергии на осуществление процесса.
-
Получение кристаллических веществ с заданными свойствами.
-
Получение веществ с наивысшей степенью чистоты (примесей ~ 10-3 грамм).
-
Разработка технологических процессов, при которых отсутствовали отходы (замкнутый цикл).
Химия изучает материю и ее главное свойство – движение. Материя – вещество и поле.
Вещество имеет признаки:
-
Занимает пространство.
-
Обладает массой покоя.
-
Построено за счет сил притяжения и отталкивания.
Поле – поток квантовых частиц, имеющие энергию и не имеющие массы покоя.
2. Основные классы неорганических соединений.
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород.
Основания – сложные вещества, состоящие из гидроксогруппы и элемента; растворимые (щелочи) и нерастворимые.
Кислоты – сложные вещества, состоящие из водорода и кислотного остатка; сильные, средние и слабые; устойчивые и неустойчивые.
Соли – сложные вещества, состоящие из кислотного остатка и элемента.
Степень диссоциации – способность распадаться на ионы.
3. Основные понятия и законы химии. Закон эквивалентов.
-
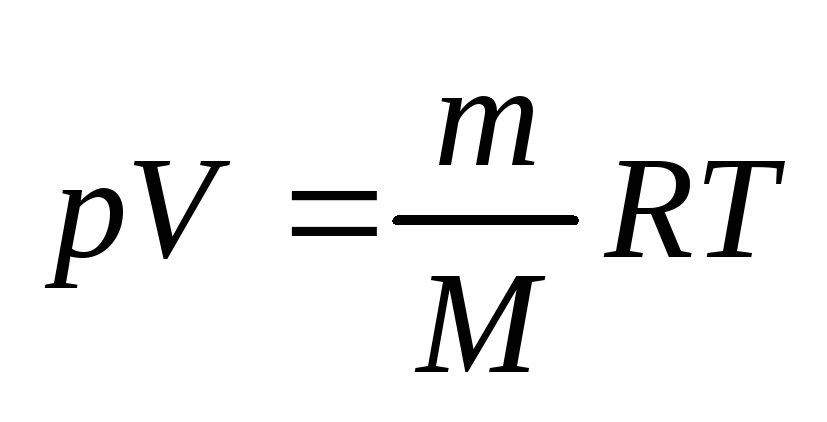 -
уравнение Менделеева-Клапейрона.
-
уравнение Менделеева-Клапейрона. -
 -
следствия закона Авагадро.
-
следствия закона Авагадро. -
 -
относительная плотность – отношение
масс равных объемов.
-
относительная плотность – отношение
масс равных объемов.
Эквивалент – реальная или условная частица, которая в кислотно-основных реакциях эквивалентна одному катиону водорода, а в окислительно-восстановительных реакциях одному электрону.
Способы определения эквивалента:
-
Простые вещества:
![]() ;
;
-
Сложные вещества:
![]() ;
;
а)
Оксиды:
![]() ;
;
б)
Соли:
![]() ;
;
в)
Кислоты:
![]() ;
;
г)
Основания:
![]() ;
;
-
Газы:
![]() .
.
![]() -
Закон
эквивалентов
– вещества реагируют друг с другом в
количествах прямопропорционально
молярным массам их эквивалентов.
-
Закон
эквивалентов
– вещества реагируют друг с другом в
количествах прямопропорционально
молярным массам их эквивалентов.
4. Строение атомов и периодическая система элементов.
![]() -
закон
Мозли,
где a,
b
– константы для аналогичных серий, Z
– порядковый номер.
-
закон
Мозли,
где a,
b
– константы для аналогичных серий, Z
– порядковый номер.
На основе закона Мозли:
-
Порядковый номер элемента имеет определенный физический смысл и выражает свойства атома – величину заряда.
-
Экспериментальный метод проверки правильного расположения элементов.
-
Установлено общее число мест в каждом периоде и послужил основой для открытия новых элементов.
Постулаты Бора:
-
Электрон вращается по определенным орбитам – стационарным. Номер стационарной орбиты n – главное квантовое число, характеризующее общий запас энергии электрона на данной орбите, его энергетический уровень.
-
При движении электрона по стационарным орбитам изменение энергии не происходит. При переходе электрона с ближней орбиты к дальней энергия поглощается, а при возвращении энергия выделяется.
-
Изменение энергии происходит квантово-дискретно:
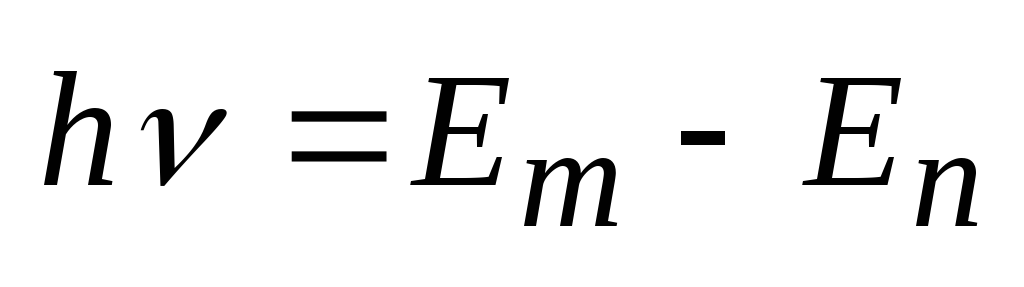 .
.
n – главное квантовое число – номер стационарной орбиты (1s2, 2s22p6). n=1, 2, 3, …
l – орбитальное квантовое число – обозначение энергетического подуровня, формы орбитали (s, p, d, f). l=0(s), 1(p), 2(d), …, n-1.
ml – магнитное квантовое число – ориентация орбиталей в пространстве. ml=0,±l.
ms – спиновое квантовое число – механический момент электрона. ms=±1/2.
Правила составления электронных конфигураций:
-
Принцип минимальной энергии:
- электроны заполняют орбитали в порядке повышения их энергии;
- в много электронных атомах кроме притяжения электроны испытывают отталкивание, поэтому последующее возрастание энергии усложняется.
-
Правила Кличковского:
- увеличение энергии происходит в порядке возрастания суммы n+l;
- если значения n+l для двух состояний одинаково, то электроны заполняют электроны с меньшим значением n.
-
Принцип Паули:
- в атоме не может быть двух электронов обладающих одинаковыми наборами квантовых чисел (n, l, ml, ms).
-
Правило Гунда:
- заполнение орбиталей одной подоболочки начинается одиночными электронами с одинаковым спином ([1 ][1 ][1 ]); s-элемент – валентные s-электроны последнего уровня, p-элемент - валентные s- и p-электроны, d-элемент – валентные s-электроны последнего и d-электроны предпоследнего уровней.
Энергия ионизации – энергия необходимая для удаления электрона из атома.
По группе энергия ионизация уменьшается, т.к. радиус увеличивается и валентные электроны менее прочно связаны с ядром.
По периоду энергия ионизации возрастает, с увеличением числа валентных электронов радиус атома уменьшается.
Энергия сродства к электрону – энергия, выделяемая в результате присоединения электрона к атому.
