
- •Механика
- •Основные формулы кинематики
- •Основы динамики
- •Статика и гидродинамика жидкостей и газов.
- •Распределение давления в покоящихся жидкости и газе.
- •Молекулярная физика и термодиамика
- •Скорости молекул газов. Экспериментальное определение скорости движения молекул.
- •Термодинамический подход к изучению физических процессов.
- •Молярная теплоемкость. Теплоемкости при постоянном давлении и постоянном объеме. Уравнение Роберта-Майера.
- •Обратимые и необратимые процессы.
- •Тепловые машины. Устройство и принцип действия тепловых двигателей.
Обратимые и необратимые процессы.
ОБРАТИМЫЙ ПРОЦЕСС в термодинамике, процесс, который возможно осуществить в обратном направлении, последовательно повторяя в обратном порядке все промежуточные состояния прямого процесса. Обратимым процессом может быть только равновесный процесс. Реальные процессы, строго говоря, являются необратимыми процессами.
НЕОБРАТИМЫЕ ПРОЦЕССЫ, диффузия, теплопроводность, вязкое течение жидкости (газа) и другие физические процессы, которые могут самопроизвольно протекать только в одном направлении — в сторону равномерного распределения вещества, теплоты и т. д.; характеризуются положительным производством энтропии. В замкнутых системах необратимые процессы приводят к возрастанию энтропии.
Необратимость тепловых процессов. Процессы теплопередачи самопроизвольно осуществляются только в одном направлении, поэтому их называют необратимыми процессами. Всегда осуществляется теплопередача тепла от горячего тела к холодному, потому что равномерное распределение быстрых и медленных молекул в двух соприкасающихся телах является более вероятным, чем такое распределение, при котором в одном теле будут только «быстрые» молекулы, а в другом — только «медленные».
Второй закон термодинамики и его статистический смысл— один из основных законов термодинамики. Устанавливает необратимость термодинамических процессов, протекающих с конечной скоростью (см. необратимые процессы). Имеет несколько эквивалентных формулировок:
1) невозможно провести процесс, единственным результатом которого был бы переход теплоты от холодного тела к нагретому (формулировка немецкого ученого Р. Клаузиуса);
2) в природе невозможен периодический процесс, единственным результатом которого является совершение работы, произведенной за счет охлаждения нагревателя (формулировка английского ученого У. Томсона);
3) невозможно создать вечный двигатель второго рода — устройство, периодически совершающее работу за счет внутренней энергии нагревателя и не изменяющее термодинамического состояния окружающих тел (формулировка немецкого физика В. Оствальда).
В современной физике второй закон термодинамики называют законом возрастания энтропии: в замкнутой макроскопической системе энтропия при любом реальном процессе возрастает. В состоянии равновесия энтропия замкнутой системы максимальна и никакие процессы в системе невозможны.
Тепловые машины. Устройство и принцип действия тепловых двигателей.
Цикл Карно - обратимый круговой процесс, состоящий из двух изотермических и двух адиабатных процессов; впервые рассмотрен Н. Л. С. Карно (1824) в связи с определением кпд тепловых машин.
Коэффициент полезного действия цикла Карно. Кпд Карно цикла не зависит от свойств рабочего тела (пара, газа и т. п.) и определяется температурами теплоотдатчика Т1 и теплоприемника Т2, = ( Т1- Т2)/ Т1. Кпд любой тепловой машины не может быть больше кпд Карно цикла (при тех же Т1 и Т2).
Холодильные машины. осуществляет искусственное охлаждение с помощью подводимой энергии (механической, тепловой и т. д.). Различают холодильные машины компрессионные (газовые и паровые), абсорбционные, пароэжекторные и термоэлектрические.
Реальные газы. отличается от идеального газа существованием взаимодействия между его частицами (молекулами, атомами). При малых плотностях наличие межмолекулярного взаимодействия учитывается вириальным уравнением состояния реального газа:
pV = RT[1 + B( T)/ v + C( T)/ v2 + ...],
где p — давление, v — мольный объем, Т — абсолютная температура, R — газовая постоянная, В( Т), С( Т) и т. д. — вириальные коэффициенты, зависящие от температуры и характеризующие парные, тройные и т. д. взаимодействия частиц в газе. Существуют и др. полуэмпирические и теоретические уравнения состояния реального газа, напр. Ван-дер-Ваальса уравнение.
Строение газообразных, твердых и жидких тел.
Свойства вещества в различных агрегатных состояниях и фазовые переходы.
Изотермы реального газа. Способность реального газа превращаться в жидкость приводит к тому, что его изотермы являются гиперболами только при температурах выше критической. Для сжижения любого газа необходимо сначала охладить его до температуры ниже критической, а затем увеличить давление до значения, превышающего давление насыщенного пара.
Критическая температура. 1) предельная температура равновесного сосуществования двух фаз (жидкости и ее пара), выше которой эти фазы неразличимы (см. Критическое состояние).2) Температура, при которой в жидких смесях с ограниченно растворимыми компонентами наступает их взаимная неограниченная растворимость (критическая температура растворимости). 3) Температура, при достижении которой вещество теряет свойства сверхпроводимости или сверхтекучести.
Зависимость давления и плотности насыщенного пара от температуры.
Кипение. интенсивный переход жидкости в пар (парообразование) вследствие образования и роста в жидкости пузырьков пара (пузырьковое кипение) или появление пленки пара на поверхности нагрева в жидкости (пленочное кипение). Температура кипения Тк при атмосферном давлении называется точкой кипения вещества
Зависимость температуры кипения жидкости от давления. При температуре 100 °С давление насыщенного водяного пара равно нормальному атмосферному давлению, поэтому при нормальном давлении кипение воды происходит при 100 °С. При температуре 80 °С давление насыщенного пара примерно в два раза меньше нормального атмосферного давления. Поэтому вода кипит при 80 "С, если давление над ней уменьшить до 0,5 нормального атмосферного давления .
При понижении внешнего давления температура кипения жидкости понижается, при повышении давления температура кипения повышается.
Влажность воздуха. содержание водяного пара в воздухе; одна из наиболее существенных характеристик погоды и климата. Количественно влажность воздуха может определяться упругостью водяного пара, абсолютной влажностью, относительной влажностью, дефицитом влажности, точкой росы.
Точка росы. температура, до которой должен охладиться воздух при данном давлении, для того чтобы содержащийся в нем пар достиг насыщения и начал конденсироваться, т. е. появилась роса.
Психрометр. прибор для измерения температуры и влажности воздуха, состоящий из двух термометров, у одного из которых («смоченного») резервуар обернут смоченным батистом. Температура определяется по «сухому» термометру, влажность — по разности показаний сухого и смоченного термометров.
Гигрометр. прибор для определения влажности воздуха. Наиболее распространены психрометр и волосной гигрометр, измеряющий относительную влажность воздуха по изменению длины обезжиренного человеческого волоса в зависимости от влажности воздуха.
Свойства жидкости. Жидкость агрегатное состояние вещества, сочетающее в себе черты твердого состояния (сохранение объема, определенная прочность на разрыв) и газообразного (изменчивость формы). Для жидкости характерны ближний порядок в расположении частиц (молекул, атомов) и малое различие в кинетической энергии теплового движения молекул и их потенциальной энергии взаимодействия. Тепловое движение молекул жидкости состоит из колебаний около положений равновесия и сравнительно редких перескоков из одного равновесного положения в другое, с этим связана текучесть жидкости.
Поверхностная энергия. избыток потенциальной энергии вещества, определяемой всеми взаимодействиями частиц, у поверхности какого-либо тела по сравнению с энергией в объеме.
Поверхностное натяжение жидкостей. стремление вещества (жидкости или твердой фазы) уменьшить избыток своей потенциальной энергии (поверхностную энергию) на границе раздела с газовой фазой (напр., с собственным паром) или др. жидкой или твердой фазой. Определяется как работа, затрачиваемая на создание единицы площади поверхности раздела фаз при постоянной температуре. Поверхностное натяжение жидкости часто определяют как силу, действующую на единицу длины контура поверхности раздела фаз и стремящуюся сократить эту поверхность до минимума. Благодаря поверхностному натяжению капля жидкости при отсутствии внешних воздействий принимает форму шара.
Сила поверхностного натяжения. Сила (касательная) действующая к поверхности и перпендикулярная участку периметра, ограничивающего поверхность жидкости.
Смачивание. поверхностное явление, возникающее при соприкосновении жидкости с твердым телом. Проявляется в растекании жидкости по твердой поверхности, пропитывании пористых тел и порошков, образовании мениска
Капиллярные явления. Опустим в воду тонкую стеклянную трубку, называемую капиллярной. Казалось бы, однородная жидкость и в широком сосуде, и в капиллярной трубке должна установиться на одном уровне. Но опыт показывает, что если один из сосудов капиллярный, то вода, которая смачивает стенки трубки, поднимается в ней на некоторую высоту h над ее уровнем в широком сосуде. Если аналогичный опыт провести с жидкостью, не смачивающей стенок трубки, то окажется, что уровень жидкости в капилляре будет ниже, чем в широком сосуде. Эти явления называются капиллярными.
Строение кристаллов. твердые тела, атомы или молекулы которых образуют упорядоченную периодическую структуру (кристаллическую решетку). Кристаллы обладают симметрией атомной структуры, соответствующей ей симметрией внешней формы, а также анизотропией физических свойств. Кристаллы — равновесное состояние твердых тел: каждому веществу, находящемуся при данных температуре и давлении, в кристаллическом состоянии соответствует определенная атомная структура. При изменении внешних условий структура кристаллов может измениться . Большинство природных и технических твердых материалов являются поликристаллами, одиночные кристаллы называются монокристаллами.
Анизотропия кристаллов. зависимость свойств среды от направления. Анизотропия характерна, напр., для механических, оптических, магнитных, электрических и др. свойств кристаллов.
Полиморфизм. свойство некоторых веществ существовать в нескольких кристаллических состояниях (модификациях) с разной структурой. Пример полиморфизма — алмаз и графит.
Монокристаллы и поликристаллы. Монокристалл, отдельный кристалл с непрерывной кристаллической решеткой. От монокристалла отличают поликристаллы. Поликристаллы , агрегаты из большого числа маленьких кристаллических зерен, ориентированных друг относительно друга хаотически. Большинство твердых технических материалов являются поликристаллическими.
Пространственная решетка. Для наглядного представления внутренней структуры кристалла применяется способ изображения его с помощью пространственной кристаллической решетки. Кристаллической решеткой называется пространственная сетка, узлы которой совпадают с центрами атомов или молекул в кристалле .
Элементарная ячейка. часть кристаллической решетки, параллельные переносы которой в трех измерениях (трансляции) позволяют построить всю кристаллическую решетку. Выбор элементарной ячейки кристалла производится различными способами. Элементарная ячейка кристалла в общем случае имеет форму параллелепипеда. Длины ребер обозначают a, b, c, а углы между ними — a, b, g.
Симметрия кристаллов. закономерность атомного строения, внешней формы и физических свойств кристаллов, заключающаяся в том, что кристалл может быть совмещен с самим собой путем поворотов, отражений, параллельных переносов (трансляций) и др. преобразований симметрии, а также комбинаций этих преобразований. Симметрия свойств кристалла обусловлена симметрией его строения.
Дефекты в кристаллах. Точечные дефекты в идеальной кристаллической решетке возникают в результате замещения собственного атома чужеродным, внедрения атома в междоузлие, отсутствия атома в одном из узлов кристаллической решетки . Нарушение в порядке расположения атомных плоскостей в кристалле (наличие лишней полуплоскости) называется дислокацией.
Аморфные тела. Аморфными называются твердые тела, у которых отсутствует кристаллическая структура. Фактически аморфные тела, у которых упаковка частиц сохраняет ближний порядок,— это переохлажденные жидкости. В природе аморфные тела встречаются редко. Примером аморфных тел могут служить куски затвердевшей смолы — янтарь, изделия из стекла.
Аморфные тела изотропны. Изотропность аморфных тел означает одинаковость физических свойств по всем направлениям..
Деформация. 1) изменение взаимного расположения точек твердого тела, при котором меняется расстояние между ними, в результате внешних воздействий. Деформация называется упругой, если она исчезает после удаления воздействия, и пластической, если она полностью не исчезает. Наиболее простые виды деформации — растяжение, сжатие, изгиб, кручение. 2) В переносном смысле — изменение формы, искажение сущности чего-либо (напр., деформация социальной структуры).
Напряжение. внутренние силы, возникающие в деформируемом теле под влиянием внешних воздействий.
Механические свойства твердых тел: упругость, пластичность, хрупкость. УПРУГОСТЬ, свойство тел восстанавливать свою форму и объем после прекращения действия внешних сил. Количественная характеристика упругих свойств материалов — модули упругости. Упругость обусловлена взаимодействием между атомами и молекулами и их тепловым движением. пластичность свойство твердых тел необратимо деформироваться под действием механических нагрузок. Пластичность определяет возможность обработки материалов давлением. ХРУПКОСТЬ, свойство тел разрушаться после незначительной пластической деформации.
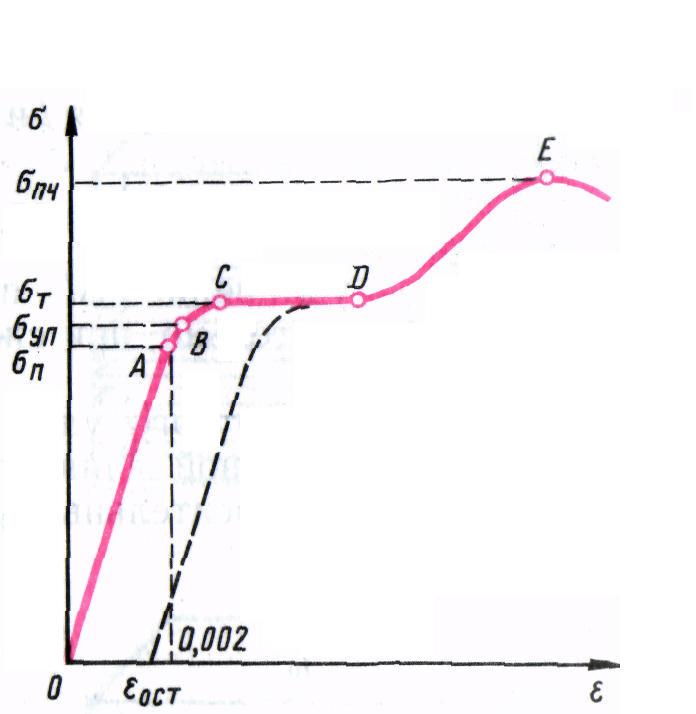
Диаграмма растяжения. Зависимость относительного удлинения oбразца от приложенного к нему напряжения является одной из важнейших характеристик механических свойств твердых тел. Графическое изображение этой зависимости называется диаграммой растяжения. По оси ординат откладывается механическое напряжение о, приложенное к образцу, а по оси абсцисс — относительное удлинение.
