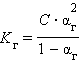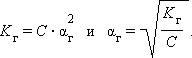Билет № 28
1. Что такое «растворы» и какие они бывают (классификация)?
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе. Подробнее остановимся на жидких растворах, в которых растворитель – жидкость. По исходному состоянию растворяемого вещества (г, ж или т) жидкие растворы можно разделить на 3 группы: (ж + г), (ж + ж) и (ж + т). К первой из них относятся такие системы, как соляная, сероводородная, сернистая кислоты, представляющие собой водные растворы газообразных HCl, H2S, SO2. К системе (ж + ж) относятся растворы спиртов, эфиров, серной и азотной кислот в воде. При этом растворенным веществом считается тот компонент, который сообщает системе специфические свойства. Третья группа растворов является самой многочисленной, т.к. к ней относятся водные растворы большинства солей, щелочей, твердых кислот (например, борной, лимонной). По типу взятого растворителя различают водные (Н2О) и неводные растворы (бензол, хлороформ, ацетон и др.)
Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении газов в жидкости энтропия всегда уменьшается ΔS < 0, а при растворении кристаллов возрастает (ΔS > 0). Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят разрушение кристаллической решетки на свободные ионы (ΔH > 0) и взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔH < 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T∙ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
В зависимости от размеров частиц растворы делятся на истинные (гомогенный) и коллоидные (гетерогенные). В истинных растворах мельчайшие частицы растворенного вещества равномерно распределены между молекулами растворителя; в коллоидных растворах не растворившиеся до конца частицы равномерно распределены между молекулами растворителя. Истинные растворы термодинамически устойчивы, время жизни стремится к бесконечности.
Растворы с меньшей концентрацией называются ненасыщенными, насыщенными – концентрация растворенного вещества максимальна при данной температуре и давлении.
Растворы имеют чрезвычайно большое практическое значение, в них протекают многие химические реакции, в том числе и лежащие в основе обмена веществ в живых организмах.
2. Формула связи константы гидролиза со степенью гидролиза.
|
|
C – концентрация соли в моль/л.
Для малых значений αr
|
|
|
|
(Индекс везде «r»)
3. Напишите варианты реакций получения кислот при взаимодействии солей и других кислот (условия протекания таких реакций).
Кислоты вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца ( выпадает осадок или выделяется газ), например: при взаимодействии серной кислоты с раствором силиката натрия образуется осадок кремниевой кислоты. H2SO4 + Na2SiO3 = H2SiO3 + Na2SO4. Реакция протекает за счёт связывания катионов водорода с силикат-ионами. При взаимодействии соляной кислоты с раствором карбоната натрия выделяется углекислый газ и образуется вода: 2HCl + Na2CO3 = 2NaCl + CO2 + H2O. Реакция протекает за счёт связывания катионов водорода и карбонат-ионов.
AgNO3 + HCl = AgCl + HNO3
2NaNO3 + H2SO4 = Na2SO4 + 2HNO3
CaCl2 + 2HNO3 = Ca(NO3)2 + 2HCl
Билет № 29
1. Дайте определение электролитам и неэлектролитам, в чем разница свойств их растворов.
Электролит-вещество, которое в расплаве или растворе диссоциирует на ионы (неорганические и органические кислоты, соли, основания – KBr, CH3COOH, NaOH). Неэлектролит-вещество, которое в растворе не диссоциирует на ионы (кислород, водород, многие органические вещества - сахара, эфиры, бензол и др.). В молекулах этих веществ существуют ковалентные не полярные или малополярные связи, которые не распадаются на ионы. Растворы электролитов проводят ток, растворы же неэлектролитов не способны проводить ток.
2. Формула произведения растворимости в системе «труднорастворимый электролит - его насыщенный раствор».
К
равновесным системам следует отнести
также и систему труднорастворимый
электролит - его насыщенный раствор. В
этом случае мы имеем дело с динамическим
гетерогенным равновесием осадок
![]() насыщенный раствор, например,
насыщенный раствор, например,
![]()
В этом растворе концентрация ионов очень мала и вследствие этого взаимодействие их друг с другом практически отсутствует. Константу равновесия для гетерогенной системы можно записать так:
![]()
концентрацию твердой фазы АgСlk можно считать постоянной, тогда
![]()
С
другой стороны,![]()
Так
как
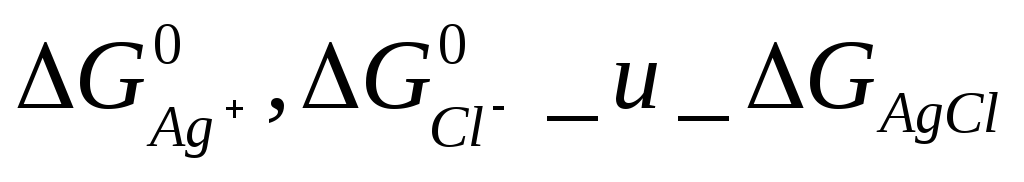 постоянные
величины, то
постоянные
величины, то
![]()
В общем
виде для уравнения
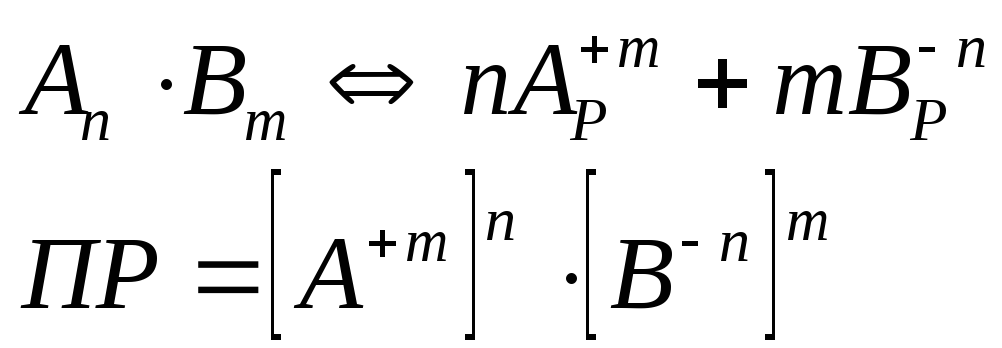
В
насыщенном растворе труднорастворимого
сильного электролита произведение
концентрации его ионов в
степенях
стехиометрических коэффициентов при
данной температуре есть величина
постоянная,
называемая
произведением растворимости (ПР).
Произведение
растворимости характеризует растворимость
труднорастворимого электролита при
данной
температуре.
Из двух однотипных солей, например,
СаSО4
с ПР = 2,5*10-5 и ВаSО4
с ПР = 1,1*10-10,
большей
растворимостью обладает та соль, у
которой ПР больше.
Концентрация
каждого иона в насыщенном растворе
электролита может быть изменена, но при
этом
изменяется
и концентрация другого иона так, что
произведение концентраций сохраняет
прежнюю
величину.
Поэтому, если в насыщенный раствор
электролита ввести некоторое количество
одного из ионов,
входящих
в состав электролита, то концентрация
другого иона должна уменьшиться и часть
растворенного
электролита
выпадет в осадок, то есть растворимость
электролита понижается от введения в
раствор
одноименных
ионов.
![]() В
общем виде растворимость L
труднорастворимого электролита AnBm
определяется соотношением
В
общем виде растворимость L
труднорастворимого электролита AnBm
определяется соотношением
3. Напишите варианты реакций получения оснований при взаимодействии металлов с водой.
2 Na
+ 2H2O = 2 NaOH + H2
Na
+ 2H2O = 2 NaOH + H2
C a
+ 2H2O = Ca(OH)2 + H2
a
+ 2H2O = Ca(OH)2 + H2
B a
+ 2H2O = Ba(OH)2 + H2
a
+ 2H2O = Ba(OH)2 + H2
2 K
+ 2H2O = 2 KOH + H2
K
+ 2H2O = 2 KOH + H2
M g
+ 2H2O = Mg(OH)2 + H2
g
+ 2H2O = Mg(OH)2 + H2