
Билет №1
1. Что является объектами изучения в химии (что такое «атом», «элемент», «молекула», «ион», «радикал» и др. – дайте определения)?
Химия – это наука о строении, свойствах веществ, их превращениях и сопровождающих явлениях.
Объектом изучения химии являются:
АТОМ – мельчайшая частица, элементов вещества, сохраняющая его свойства, не делимая химическим путем.
МОЛЕКУЛА – мельчайшая частица сложного вещества, сохраняющая его свойства, способная самостоятельно существовать.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ – составная часть вещества, содержащая одинаковые атомы.
ИОНЫ – монозаряженные частицы ,образующиеся в результате отрыва или замещения электронов. Атомы, лишившиеся электрона – положительно заряженные, а те, которые получили этот электрон – отрицательно заряженные ионы.
ВАЛЕНТНОСТЬ – это способность присоединять или замещать определенное число атомов.
СТЕПЕНЬ ОКИСЛЕНИЯ – условный заряд атома элемента, полученный в предположении, что соединение получено из ионов.
РАДИКАЛЫ – частицы, образующиеся при разрыве химической связи и содержащие в себе неспаренные электроны.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ – это способность притягивать электроны. Электроотрицательность уменьшается с увеличением порядкового номера элемента. В периодах Электроотрицательность растет, в группах уменьшается.
2. Закон действующих масс (уравнение скорости химической реакции).
Коэффициент пропорциональности называют константой скорости. Очевидно, для реакции аА + bB, то есть для а молей вещества А и b молей вещества В ЗДМ формально запишется в виде
![]()
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. Это определение относится к гомогенным реакциям. Если реакция гетерогенная (реагенты находятся в разных агрегатных состояниях), то в уравнении ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k. Константа скорости k численно равна скорости, если концентрации реагентов постоянны и равны единице. Закон действующих масс безусловно выполняется только для элементарных химических реакций, протекающих в одну стадию. В других случаях фактическая и вычисленная по закону действующих масс скорости совпадают редко.
3 .
Напишите
варианты реакций замещения галогена в
соли при ее взаимодействии со щелочью
(какие еще типы реакций вы знаете).
.
Напишите
варианты реакций замещения галогена в
соли при ее взаимодействии со щелочью
(какие еще типы реакций вы знаете).
C uCl2
+ 2NaOH = 2NaCl + Cu(OH)2
uCl2
+ 2NaOH = 2NaCl + Cu(OH)2
AlCl3 + 3KOH = 3 KCl + Al(OH)3
C
 aCl2
+ 2KOH = 2KCl + Ca(OH)2
aCl2
+ 2KOH = 2KCl + Ca(OH)2
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
LiCl + KOH = KCl + LiOH
Также существуют реакции замещения, соединения, разложения, обмена, отщепления (элиминирования), сгорания, перегруппировки (изомеризации), реакция окисления и др.
Билет №2
1. Чему равен атомный номер (Z) и массовое число (A) элемента, а также что обозначают верхний и нижний индексы при символах элементов (например, 126С)?
Атомный номер Z равен числу протонов в атомном ядре (порядковый номер элемента). В электронной оболочке электронейтрального атома содержится Z электронов. Массовое число А равно сумме числа протонов Z и числу нейтронов N: (A=Z+N). Левые индексы элемента указывают – массовое число А (верхний) и число протонов Z (нижний).


 126С
= р=6 6е
126С
= р=6 6е
n=6
2. Зависимость константы скорости реакции от температуры (уравнение Аррениуса).
При фиксированной температуре реакция возможна, если взаимодействующие молекулы обладают определимым запасом энергии. Аррениус эту избыточную энергию назвал энергией активации, а сами молекулы активированными,
По
Аррениусу константа скорости k и энергия
активации
![]() связаны соотношением, получившим
название уравнения Аррениуса:
связаны соотношением, получившим
название уравнения Аррениуса:
![]()
Здесь А - предэкспоненциальный множитель, К - универсальная газовая постоянная, Т – абсолютная температура.
Таким образом, при постоянной температуре скорость реакции определяет Еа. Чем больше Еа, тем меньше число активных молекул и тем медленнее протекает реакция. При уменьшении Еа скорость возрастает, а при Еа = 0 реакция протекает мгновенно,
Если Еа = 50-100 кДж*Моль-1, то из уравнения Аррениуса следует, что при изменении температуры реакции на 10 градусов ее скорость изменится в 2-4 раза. Это правило было эмпирически установленно Вант-Гоффом.
3. Напишите вариант реакции присоединения галогена к неорганическому веществу (какой тип связи в этом соединении).
Cl2+H2=2HCl
В результате тесного сближения атомов водорода и хлора атом хлора, которому не хватает одного электрона до конфигурации благородного газа, оттянет на себя электронную оболочку атома водорода (состоящую из одного электрона). В результате на атоме хлора образуется избыточный отрицательный заряд, а на атоме водорода - избыточный положительный заряд. То есть молекула НСl представляет собой электрический диполь. Химическая связь подобного тала называется полярной ковалентной связью.
F2+H2=2HF
I2+H2=2HI
Br2+H2=2HBr
Билет №3
1. Что такое «изотопы», «изобары», «изотоны» (примеры таких химических элементов)?
ИЗОТОПЫ – атомы с одинаковым числом протонов (Z), но различным атомным числом (A) и числом нейтронов (N).
![]() углерод-12
углерод-12
![]() углерод-13
углерод-13
ИЗОБАРЫ – атомы с одинаковым атомным числом, но различным числом протонов и нейтронов.
![]() калий-40
калий-40
![]() кальций-40
кальций-40
ИЗОТОНЫ – атомы с одинаковым числом нейтронов, но разными атомным числом и числом протонов.
![]() радий-228
радий-228
![]() торий-230
торий-230
Атомы с определенным числом протонов и нейтронов называются НУКЛИДЫ.
2. Температурный коэффициент скорости химической реакции (правило Вант-Гоффа).
Скорость химической реакции зависит от температуры, причем при повышении температуры скорость реакции увеличивается. Голландский уч1ный Вант-Гофф показал, что при повышении температуры на 10 градусов скорость большинства реакций увеличивается в 2-4 раза;
VT2=VT1*y(T2-T1)/10
Где VT2 и VT1 – скорости реакции при температурах T2 и T1 ; у – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличилась скорость реакции при повышении температуры на 10К.
При концентрации реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости k. Тогда уравнение показывает, что константа скорости зависит от температуры так же, как и скорость процесса.
3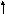 .
Напишите
вариант реакции отщепления (элиминирования)
с выделением галогенводорода.
.
Напишите
вариант реакции отщепления (элиминирования)
с выделением галогенводорода.
C2H5Cl=C2H4+HCl
Билет №4
1. Что такое «атомная масса», «молекулярная масса», «моль вещества» и что принято за атомную единицу массы (а.е.м.)?
АТОМНАЯ МАССА - масса атома в атомных единицах массы (а. е. м.). За единицу а. е. м. принята 1/12 массы изотопа углерод- 12.
а.е.м. = 1/12 m 126С = 1, 66 * 10-24
МОЛЕКУЛЯРНАЯ МАССА - молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
МОЛЬ - количество вещества, содержащее столько же частиц или структурных единиц (атомов, ионов, молекул, радикалов, электронов, эквивалентов и др.), что и в 12 а. е. м. изотопа углерода-12.
2. Формула увеличения скорости реакции в присутствии катализатора.
Изменить величину Еа (энергию активации) можно с помощью катализаторов. Вещества, принимающие участие, но не расходующиеся в процессе реакции, назваются катализаторами. Само это явление называется катализом. Увеличение скорости реакции в присутствии катализатора определяется формулой
В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. Механизм каталитического действия для них не одинков, однако и в том и в другом случае происходит ускорение реакции за счет снижения Еа. Существует ряд специфических катализаторов - ингибиторов, снижающих скорость реакции.

где
![]() -параметры
каталитического процесса, V,
k
, Еа- некаталитического процесса.
-параметры
каталитического процесса, V,
k
, Еа- некаталитического процесса.
3. Напишите реакции сгорания углеродсодержащих неорганических веществ в кислороде, указав окислитель и восстановитель, а также степени окисления углерода до и после реакции.
![]()
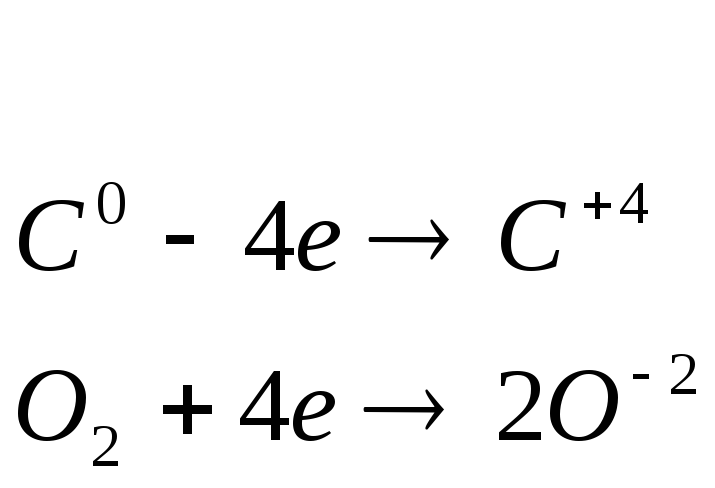
С – восстановитель, процесс окисления
О – окислитель, процесс восстановления
Билет № 5
1. Что такое «электроотрицательность», «валентность», «степень окисления» элемента и каковы основные правила их определения?
СТЕПЕНЬ ОКИСЛЕНИЯ — условный заряд атома элемента, полученный в предположении, что соединение состоит из ионов. Она может быть положительной, отрицательной, нулевой, дробной и обозначается арабской цифрой со знаком «+» или «-» в виде верхнего правого индекса символа элемента: С1-, О2-, Н+, Мg2+, N3-, N5+, Сr6+.
Для определения степени окисления (с. о.) элемента в соединении (ионе) пользуются следующими правилами:
1 В простых веществах (Н2, S8, Р4) с. о. равна нулю.
2 Постоянную с. о. имеют щелочные (Э+) и щелочно-земельные (Э2+) элементы, а также фтор Р-.
3 Водород в большинстве соединений имеет с. о. Н+ (Н2О, СН4, НС1), в гидридах - Н- (-NaН, СаН2); с. о. кислорода, как правило, равна -2 (О2-), в пероксидах (-О-О-) — 1 (О-).
4 В бинарных соединениях неметаллов отрицательная с. о. приписывается элементу, расположенному справа ).
5 Алгебраическая сумма с. о. молекулы равна нулю, иона - его заряду.
Способность атома присоединять или замещать определенное число других атомов называют ВАЛЕНТНОСТЬЮ. Мерой валентности считают число атомов водорода или кислорода, присоединенных к элементу, при условии, что водород одно- , а кислород двухвалентен.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (ЭО) - способность атома оттягивать на себя электрон в химическом соединении.
В основу электроотрицательности положены следующие физические обоснования (шкалы):
Шкала Полинга базируется на энергии связи при образовании сложного вещества из простых.
Шкала Малликена - ЭО пропорциональна полуразности первого потенциала ионизации и сродства к электрону ЭО ~ 0,5 • (II + Еср).
Шкала Олреда-Рохова основана на электростатической силе, действующей на внешний электрон
![]() ,
,
где Zэф — эффективный заряд ядра атома, е - заряд электрона; г - ковалентный радиус.
Разность электроотрицательностей элементов в соединении пропорциональна ионности связи взаимодействующих атомов; нулевая разность соответствует образованию ковалентной связи.
2. Закон сохранения энергии или первое начало термодинамики (зависимость теплового эффекта от изменения внутренней энергии системы и ее объема при постоянном давлении).
Внутренняя энергия системы U складывается из энергии движения и взаимодействия молекул, энергии связи в молекулах, энергии движения и взаимодействия электронов и ядер и т. п.
Абсолютная
величина внутренней энергии не может
быть определена, но ее изменение при
переходе системы из начального состояния
в конечное в результате осуществления
химического процесса поддается расчету.
Если система получает некоторое
количество тепла при постоянном давлении
Qр,
последнее расходуется на изменение
внутренней энергии системы
![]() и совершение работы
и совершение работы
![]() против внешних сил:
против внешних сил:
![]()
3. Напишите варианты реакций перегруппировки (изомеризации) органического и неорганического соединения.
СН3
—
СН2
—
СН2
—
СНг—
СН3
![]() СН3
— СН(СН3)
—
СНг
— СН3
СН3
— СН(СН3)
—
СНг
— СН3
пентан 2-метилбутан
Билет № 6
1. Какие бывают химические формулы (приведите примеры) и в каком порядке в них указываются элементы?
Химическая формула – это выражение состава веществ по средством химических знаков и индексов. Она показывает: качественный состав (из атомов каких элементов состоит вещество), количественный состав (сколько атомов каждого элемента входит в состав молекулы вещества). Индекс показывает число атомов в молекуле.
В настоящее время различают следующие виды химических формул:
Простейшая формула. Может быть получена опытным путем через определение соотношения химических элементов в веществе с применением значений атомной массы элементов. Так, простейшая формула воды будет H2O, а простейшая формула бензола СН. Атомы в формулах обозначаются знаками химических элементов, а относительное их количество — числами в формате нижних индексов.
Истинная формула. Может быть получена, если известна молекулярная масса вещества. Истинная формула воды Н2О, что совпадает с простейшей. Истинная формула бензола С6Н6, что отличается от простейшей. Истинные формулы называют эмпирическими, а также брутто-формулами. Они отражают состав, но не структуру молекул вещества.
Рациональная формула. В рациональных формулах выделяются группы атомов, характерные для классов химических соединений. Например, для спиртов выделяется группа -ОН. При записи рациональной формулы такие группы атомов заключаются в круглые скобки (ОН). Количество повторяющихся групп обозначаются числами в формате нижних индексов, которые ставятся сразу за закрывающей скобкой. Квадратные скобки применяются для отражения структуры комплексных соединений. Например, К4[Co(CN)6] — гексацианокобальтоат калия. Рациональные формулы часто встречаются в полуразвернутом виде, когда часть одинаковых атомов показываются по отдельности для лучшего отражения строения молекулы вещества.
Структурная формула. В графическом виде показывает взаимное расположение атомов в молекуле. Химические связи между атомами обозначаются линиями. Различают двухмерные (2D) и трехмерные (3D) формулы. Двухмерные представляют собой отражение структуры вещества на плоскости. Трехмерные позволяют наиболее близко к теоретическим моделям строения вещества представлять его состав, взаимное расположение, связи и расстояния между атомами.
Пример: Этанол
Простейшая формула С2Н6О
Истинная, эмпирическая, или брутто-формула: С2Н6О
Рациональная формула: С2Н5ОН
Рациональная формула в полуразвернутом виде: СН3СН3ОН
Структурная формула (2D):
Н Н
| |
Н-С-С-О-Н
| |
Н Н
Катион в формулах солей всегда ставится на первое место: МgС12, КМnО4, (МН4)2СОЗ.
Если соль содержит более одного катиона или более одного аниона, то в формуле они записываются в алфавитном порядке их символов: КСr(SО4)2, РtBr2С12.
Кислоты рассматриваются как соли протона Н+: НС1, Н2SО4, НЗРО4.
Основания - соединения, у которых анионом служит гидроксил-ион ОН-: КОН, А1(ОН)3.
2. Первый закон термодинамики для адиабатического процесса (при квазистатическом изменении объема в сосуде с теплонепроницаемыми стенками).
Внутренняя
энергия системы и складывается из
энергии движения и взаимодействия
молекул, энергии
связи
в молекулах, энергии движения и
взаимодействия электронов и ядер и т.
п. Абсолютная
величина внутренней энергии не может
быть определена, но ее изменение при
переходе
системы
из начального состояния в конечное в
результате осуществления химического
процесса поддается
расчету.
Если система получает некоторое
количество тепла при постоянном давлении
Qр,
последнее
расходуется
на изменение внутренней энергии системы
![]() и совершение работы
и совершение работы
![]() против
внешних
сил:
против
внешних
сил:
![]()
Это уравнение выражает закон сохранения энергии или первое начало термодинамики.
Адиабатический
процесс - это процесс квазистатического
расширения или сжатия газа в сосуде с
теплонепроницаемыми
стенками. Первый закон термодинамики
для адиабатического процесса принимает
вид
![]()
3. Напишите варианты реакций частичного окисления неорганических веществ на примере соединений переходных металлов.
Билет № 7
1. Чем отличается простое вещество от сложного и какие вы знаете классы неорганических веществ?
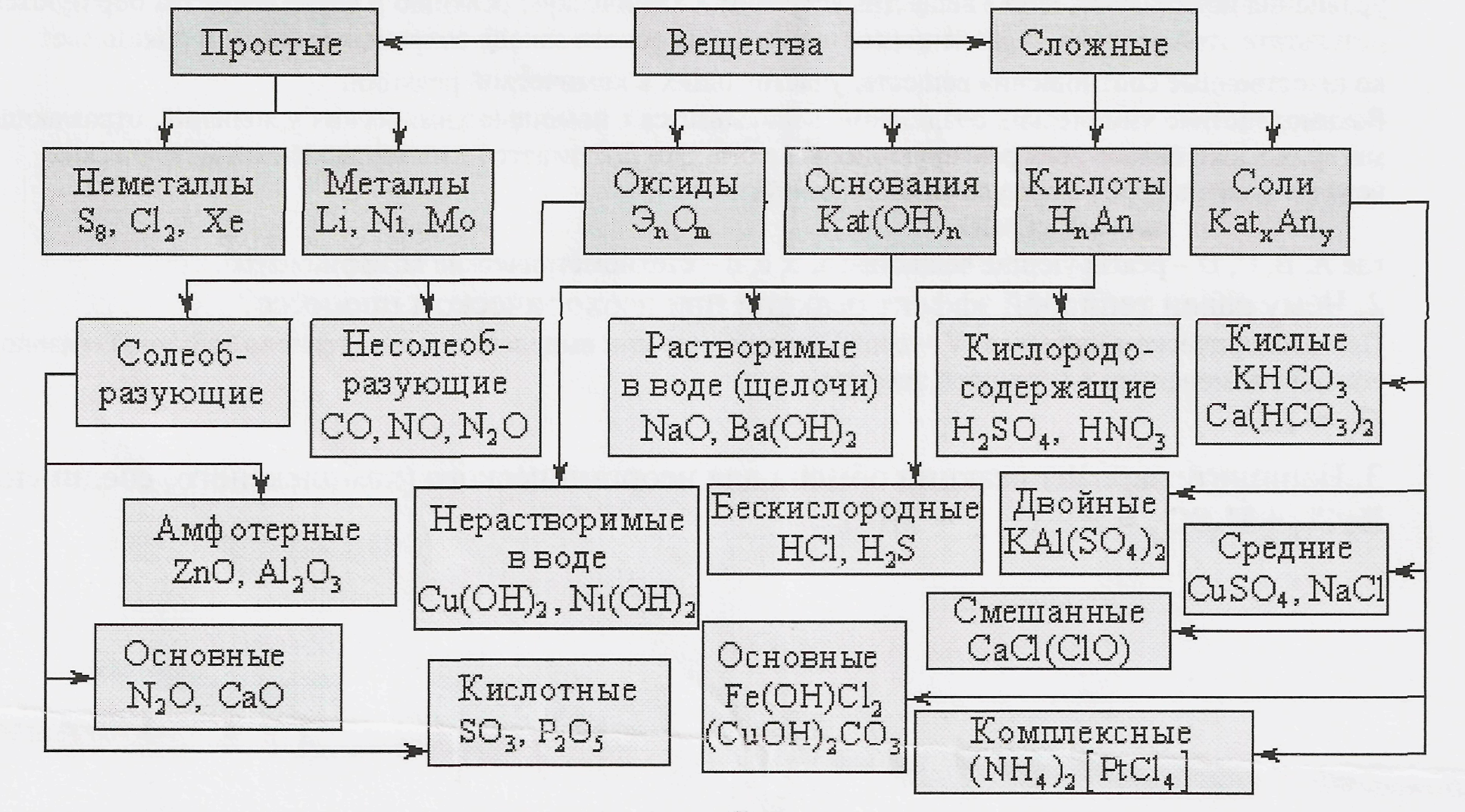
Простые вещества состоят из атомов одного элемента (Mg, Na, Fe), сложные – из атомов разных элементов (H2O, CO2, NaCl).
2. Первый закон термодинамики для изотермического процесса (квазистатического изменения объема вещества при его контакте с «тепловым резервуаром»).
Внутренняя
энергия системы и складывается из
энергии движения и взаимодействия
молекул, энергии
связи
в молекулах, энергии движения и
взаимодействия электронов и ядер и т.
п. Абсолютная
величина внутренней энергии не может
быть определена, но ее изменение при
переходе
системы
из начального состояния в конечное в
результате осуществления химического
процесса поддается
расчету.
Если система получает некоторое
количество тепла при постоянном давлении
Qр,
последнее
расходуется
на изменение внутренней энергии системы
![]() и совершение работы
и совершение работы
![]() против
внешних
сил:
против
внешних
сил:
![]()
Это уравнение выражает закон сохранения энергии или первое начало термодинамики.
Изотермический процесс - это процесс квазистатического расширения или сжатия вещества, находящегося в контакте с тепловым резервуаром, (Т = const).
Так как внутренняя энергия идеального газа зависит только от температуры (закон Джоуля), то первый закон термодинамики для изотермического процесса записывается в виде:
Q=A.
3. Напишите варианты цепных реакций с участием неорганических соединений.
Примером неразветвленной цепной реакции может служить Н2 + Вг2 = 2НВг, иницирование которой определяется термо- и фотодиссоциацией:
иницирование:
![]()
рост
цепи (развитие):![]()
обрыв
цепи:![]()
Билет № 8
1. Что показывает химическое уравнение (приведите пример)?
Выражение реакции при помощи химических формул называется химическим уравнением. Химические уравнения показывают, какие вещества вступают в химическую реакцию и какие вещества образуются в результате этой реакции. Уравнение составляется на основе закона сохранения массы и показывает количественные соотношения веществ, участвующих в химической реакции.
Взаимодействие химических соединений записывается с помощью химических уравнений, отражающих материальный баланс всех реагирующих веществ. Это достигается с помощью стехиометрических коэффициентов перед формулами соединений: aA+bB=cC+dD
где А, В, С, D - реагирующие вещества; а, b, с, d - стехиометрические коэффициенты.
2. Чему равен тепловой эффект реакции при изохорическом процессе?
Внутренняя
энергия системы и складывается из
энергии движения и взаимодействия
молекул, энергии
связи
в молекулах, энергии движения и
взаимодействия электронов и ядер и т.
п. Абсолютная
величина внутренней энергии не может
быть определена, но ее изменение при
переходе
системы
из начального состояния в конечное в
результате осуществления химического
процесса поддается
расчету.
Если система получает некоторое
количество тепла при постоянном давлении
Qр,
последнее
расходуется
на изменение внутренней энергии системы
![]() и совершение работы
и совершение работы
![]() против
внешних
сил:
против
внешних
сил:
![]()
Это уравнение выражает закон сохранения энергии или первое начало термодинамики.
При
изохорическом процессе (V
= const)
поглощение или выделение тепла (тепловой
эффект) связано только с изменением
внутренней энергии:
![]()
3. Напишите варианты реакций обмена для неорганических соединений.
![]()
Al2O3 + 6HCl = 2AlCl3 + 3H2O
CuO + H2SO4 = CuSO4 + H2O
2NaOH + H2SO4 =NaSO4 + 2H2O
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Билет № 9
1. Перечислите важнейшие типы химических реакций.
Химическая реакция —взаимодействие простых или сложных веществ друге другом.
Реакция разложения Из одного сложного вещества получается два и более простых или сложных веществ. Часто эти реакции идут при высоких температурах.
![]()
Реакции соединения Обратная разложению (но не все реакции разложения можно заставить идти в обратном направлении). Из двух или нескольких простых или сложных веществ образуется одно сложное.
![]()
Реакция замещении Атомы простого вещества чамешают атомы одного из элементов сложного вещества
![]()
Реакция обмена Два сложных вещества обмениваются своими составными частями
![]()
Также существуют отщепления (элиминирования), сгорания, перегруппировки (изомеризации), реакция окисления и др.
2. Чему равен тепловой эффект реакции при изобарическом процессе?
Q (тепловой эффект) – это количество тепла, которое выделяет или поглощает 1 моль вещества при p=const и t=const.
![]()
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
![]()
![]()
3. Напишите варианты реакций отщепления элемента с изменением степени окисления атома для неорганического соединения.
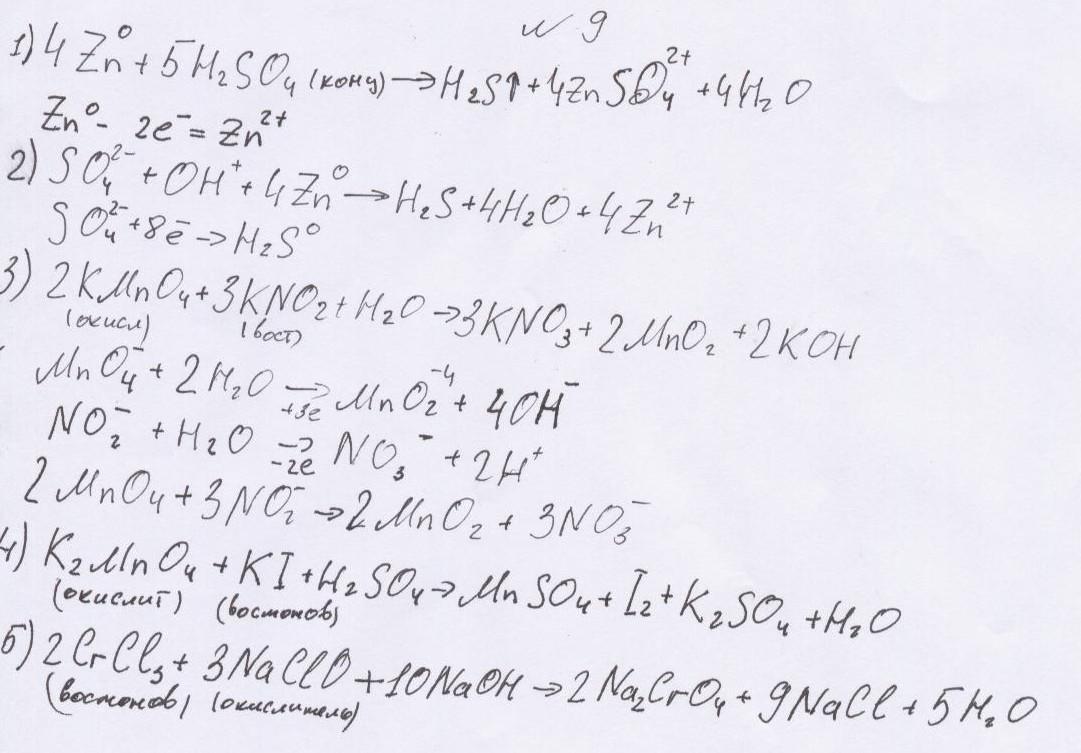
Билет № 10
1. Как устроен атом и его электронная оболочка?
Атом
состоит из положительно заряженного
ядра и отрицательно заряженных электронов.
Ядро
состоит из протонов и нейтронов. Число
протонов равно порядковому номеру
элемента в таблице Менделеева. Число
нейтронной равно разности между атомной
массой и порядковым номером. Заряд ядра
определяется зарядом протонов. Число
электронов равно числу протонов. .
Электрон
- волна в пространстве,
представляет
собой как бы облако. Орбиталь
- область в пространстве, в которой
вероятность нахождения электрона
максимальна. Состояние
электрона
в атоме описывается значением четырех
квантовых чисел: Главное
квантовое число
- n
- описывает возможные энергетические
состояния электрона в атоме. Побочное
квантовое число — l
— определяет форму электронной орбитали.
Магнитное
– квантовое число - m
- определяет ориентацию магнитных
орбиталей в пространстве. Спиновое
квантовое число
-
![]() - характеризует собственное вращение
электрона вокруг своей оси.
- характеризует собственное вращение
электрона вокруг своей оси.
2. Сформулируйте закон Гесса и приведите уравнение для одного из его следствий.
Независимость теплоты химической реакции от пути процесса при p=const и T=const была установлена в первой половине XIX века русским ученым Г. И. Гессом:
Тепловые эффекты химических реакций, протекающих или при постоянном объеме, или при постоянном давлении, не зависят от числа промежуточных стадий и определяются точно начальными веществами и продуктами реакций, а также их физическим состоянием.
Закон Гесса позволяет рассчитывать теплоту реакции, если её экспериментальное определение затруднительно.
Анализ закона Гесса позволяет сформулировать следующие следствия:
Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов: ΔH = ΣΔHобр.конечн – ΣΔHобр.нач
Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов. ΔH = ΣΔHсгор.нач – ΣΔHсгор.конечн
Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов. В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образованиии продуктов реакции (–ΣEпрод). Отсюда ΔH° = ΣEисх – ΣEпрод
Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком. ΔHобр = –ΔHразл
Энтальпия гидратации равна разности энтальпий растворения безводной соли ΔH° раств.б/с и кристаллогидрата ΔH° раств. крист
Одно из следствий закона Гесса говорит, о том, что Тепловой эффект реакции с участием органических веществ равен сумме теплот сгорания реагентов за вычетом теплот сгорания продуктов. При этом теплота сгорания определяется в предположении полного сгорания: углерод окисляется до CO2, водород − до H2O, азот − до N2 .
Тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов называется теплотой сгорания этого вещества (ΔН0сг.). При этом очевидно, что теплоты сгорания O2, CO2, H2O, N2 принимаются равными нулю.
Например, теплоту сгорания этанола
C2H5OH(ж) + 3O2 = 2CO2 + 3H2O(г)
можно рассчитать по уравнению первого следствия:
ΔH0х.р. = ΔН0сг(C2H5OH) = 2ΔН0ƒ,(CO2) +3ΔН0ƒ,(H2O) − ΔН0ƒ,(C2H5OH).
Подставляя данные из табл. термодинамических констант некоторых веществ, получаем стандартную теплоту сгорания этанола
ΔН0сг (C2H5OH) = 2(−393,5) + 3(241,8) – (−277,7) = −1234,7 кДж/моль.
Значения теплот сгорания приведены в справочниках.
3. Напишите реакции, происходящие при разрядке свинцового аккумулятора.
|
|
|
Билет № 11
1. Назовите квантовые числа электрона в атоме и нарисуйте основные типы атомных орбиталей.
Состояние
электрона в атоме описывается значением
четырех квантовых чисел: Главное
квантовое число -
n
- описывает возможные энергетические
состояния электрона в атоме.
Орбитальное(Побочное) квантовое
число -l
- определяет форму электронной орбитали.
Магнитное квантовое число - m
- определяет ориентацию магнитных
орбиталей в пространстве. Спиновое
квантовое число
-
![]() - характеризует собственное вращение
электрона вокруг своей оси.
- характеризует собственное вращение
электрона вокруг своей оси.
S(орбитальное к.ч. 0) - Орбиталь максимально па ней находится 2 электрона
Р(орбитальное к.ч. 1) - Орбиталь максимально на ней находится 6 электронов
D(орбитальное к.ч. 2) -Орбиталь максимально на ней находится 10 электронов
F(орбитальное к.ч. 3) - Орбиталь максимально на ней находится 14 электронов
2. Формула Больцмана для энтропии как термодинамической вероятности состояния системы.
Энтропия (S) – это количественная мера степени неупорядоченности системы.
Зависит от температуры. Чем выше температура, тем выше степень неупорядоченности.
Молекулярную природу энтропии раскрыл австрийский физик Людвиг Больцман (1844-1906). Связь энтропии с молекулярным хаосом он описал формулой S=k*lnW, где W – термодинамическая вероятность, k – постоянная величина, называемая константой Больцмана, которая связана с газовой постоянной соотношением k=R/NA (NA – постоянная Авогадро) и равна 1.38*10-23 Дж/К
Энтропия скачкообразно изменяется при фазовых переходах вещества. Она повышается при плавлении, так как разрушается упорядоченная кристаллическая решетка, и ,особенно, при испарении, поскольку резко возрастает объем, доступный для хаотичного движения молекул. Процессы же кристаллизации и конденсации вещества, наоборот, приводят к уменьшению энтропии. Снижается она, хотя и не так резко, и при охлаждении газов, жидкостей, твердых тел. В идеально правильном кристалле при температуре абсолютного нуля (-2730С) энтропия равна нулю.
Прибора, который показывал бы величину энтропии, не существует. В то же время энтропию или ее изменение можно рассчитать. Например, увеличение энтропии вещества ΔS, вызванное добавлением количества теплоты ΔQ при температуре T, определяется по формуле: ΔS=ΔQ/T. Единицей измерения энтропии является Дж/К или Дж/(моль*К)
Критерий самопроизвольности процесса устанавливается вторым законом термодинамики. Он имеет несколько формулировок, равнозначность которых не всегда очевидна на первый взгляд. Впервые второй закон термодинамики был сформулирован в 1850 году Клазиусом: Тепло не может переходить самопроизвольно от менее нагретого тела к более горячему.
3. Напишите вариант реакции какого-нибудь металла-лантаноида или его окисла с водой. Определение амфотерности.
Л антаноиды
– это 14 элементов, следующих за лантаном,
у которых к электронной конфигурации
лантана последовательно добавляются
14 4f-электронов. В свободном состоянии
лантаноиды – весьма активные металлы.
(В рядунапряжений они находятся
значительно левее водорода),
электродные
потенциалы лантаноидов
составляют около –2,4 В). Поэтому все
лантаноиды
взаимодействуют с водой
с выделением водорода:
2Э + 6Н2О
= 2Э(ОН)3
+ 3Н2
антаноиды
– это 14 элементов, следующих за лантаном,
у которых к электронной конфигурации
лантана последовательно добавляются
14 4f-электронов. В свободном состоянии
лантаноиды – весьма активные металлы.
(В рядунапряжений они находятся
значительно левее водорода),
электродные
потенциалы лантаноидов
составляют около –2,4 В). Поэтому все
лантаноиды
взаимодействуют с водой
с выделением водорода:
2Э + 6Н2О
= 2Э(ОН)3
+ 3Н2
2 Nd
+ 6Н2О
= 2Nd
(ОН)3
+3Н2
(Неодим)
Nd
+ 6Н2О
= 2Nd
(ОН)3
+3Н2
(Неодим)
Амфотерность (от греч. amphoteros - и тот и другой) – способность некоторых химических соединений, напр. гидроксидов, аминокислот, взависимости от условий проявлять либо основные, либо кислотные свойства. Напр., в присутствии кислот Al(OH)3 ведет себя как основание
2 Pm
+ 6Н2О
= 2Pm
(ОН)3
+3Н2
(Прометий)
Pm
+ 6Н2О
= 2Pm
(ОН)3
+3Н2
(Прометий)
2 Gd + 6Н2О
= 2Pm
(ОН)3
+3Н2
(Гадолиний)
Gd + 6Н2О
= 2Pm
(ОН)3
+3Н2
(Гадолиний)
2 Ho + 6Н2О
= 2Но
(ОН)3
+3Н2
(Гольмий)
Ho + 6Н2О
= 2Но
(ОН)3
+3Н2
(Гольмий)
2 Er + 6Н2О
= 2Er
(ОН)3
+3Н2
(Эрбий)
Er + 6Н2О
= 2Er
(ОН)3
+3Н2
(Эрбий)
|Неодим |Nd |4f46s2 |+3 |
|Прометий |Pm |4f56s2 |+3 |
|Гадолиний |Gd |4f75d16s2 |+3 |
|Гольмий |Ho |4f116s2 |+3 | |Эрбий |Er |4f126s2 |+3 |
Билет № 12
1. Что такое энергетический уровень и в каком порядке происходит их заполнение в атомах (принцип Паули, правила Гунда и Клечковского)?
Энергетический уровень - состояние электрона, характеризующееся различными значениями l -(орбитальное квантовое число).
S(орбитальное к.ч. 0) - Орбиталь максимально на ней находится 2 электрона
Р(орбитальное к.ч. ]) - Орбиталь максимально на ней находится 6 электронов
D( орбитальное к.ч. 2) - Орбиталь максимально на ней находится 10
электронов
F(орбитальное к.ч. 3) - Орбиталь максимально на ней находится 14 электронов
1 n 28, 2р|35,Зр|-Ч Зс1, 4р|5ь, 4с1, 5р|б8,4Г, 5с!, 6р|7я, 5Г, 6(1, 7р
Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами).
Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду:
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s.
Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
2. Формула изобарно-изотермического потенциала (свободной энергии Гиббса) и что он характеризует.
Энергия Гиббса обозначается буквой G и определяется как ΔG=ΔH-TΔS. Названа она в честь одного из основателей -химической термодинамики, американского ученого Джозайи Уилларда Гиббса (1839-1903).
Теперь критерий самопроизвольности реакции и ее равновесия можно выразить через изменение энергии Гиббса системы:
ΔG < 0 - самопроизвольная реакция;
ΔG = 0 – реакция находится в состоянии равновесия;
ΔG > 0 – несамопроизвольная реакция (самопроизвольна обратная реакция).
Рассчитав ΔG химической реакции, можно, не проводя экспериментов, дать ответ о принципиальной (термодинамической) возможности (или невозможности ее протекания).
Знак ΔG, а значит, и самопроизвольность реакции зависит от соотношения величин ΔH и ТΔS. (ΔH положительно для эндотермических реакций и отрицательно для экзотермических). При низких температурах произведение ТΔS часто мало по сравнению с ΔH, и в формуле ΔG=ΔH-TΔS этим членом можно пренебречь. В таком случае знак ΔG определяется знаком ΔH, и самопроизвольно идут только экзотермические реакции.
3. Напишите вариант реакции диспропорционирования для какого-нибудь актиноида или другого элемента.
![]() (плутоний)
(плутоний)
|
Элемент |
Электронная конфигурация |
Степень окисления |
|
|
|
|||||
|
Торий |
Th |
5f 27s 2 |
3, 4 |
|
|
|
|
|||
|
Протактиний |
Pa |
5f 37s 2 |
3, 4, 5 |
|
|
|
|
|||
|
Берклий |
Bk |
5f 97s 2 |
3, 4 |
|
||||||
|
Калифорний |
Cf |
5f 107s 2 |
2, 3 |
|
||||||
|
Плутоний |
Pu |
5f 67s 2 |
3, 4, 5, 6, 7 |
|
||||||
Билет № 13
1. Что такое электронные формулы элементов (приведите пример) и какие еще бывают формулы их изображения?
В записи электронных формул первая цифра равна n, буква после нее соответствует 1, а правый верхний индекс равен числу электронов в тгсм состоянии. Например, электронная формула лития - 1s2 2s1, углерода -1s2 2s2 2р2. Заселенность электронных оболочек может быть представлена в виде квантовых ячеек. В отличии от электронных формул, здесь используются не два. а все четыре числа. Свободная ячейка означает свободную орбиталь, которую может занимать электрон при возбуждении атома.
2. Уравнение изотермы Вант-Гоффа.
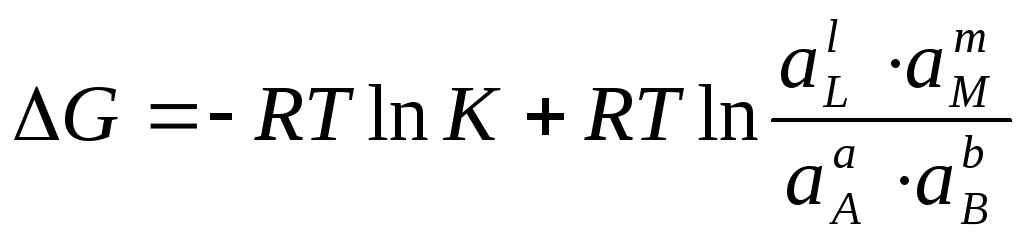
![]()
![]()
![]()
![]() – равновесные
значения активных концентраций
– равновесные
значения активных концентраций
Выражение под знаком логарифма, представляющее собой отношение произведения равновесных активностей продуктов к произведению активностей исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия
3. Напишите вариант реакции соединения двух неорганических веществ между собой с образованием сложного вещества.
CaO + CO2 = CaCO3
4Al + 3O2 = 2Al2O3
2Na + SO4 = Na2SO4
3K + PO4 = K3PO4
2Al + 3SO4 = Al2(SO4)3
Билет № 14
1. Определите местонахождение в периодической системе s-, p-, d- и f-элементов.
По вертикали периодическая система подразделяется на восемь групп, которые делятся на главные - А, состоящие из s- и p-элементов, и побочные - В-подгруппы, содержащие d-элементы. Подгруппа III В, кроме d-элементов, содержит по 14 4f- и 5f-элементов (4f- и 5f-семейства). Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы.
В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на 5- и p-орбиталях внешнего энергетического уровня, в побочных - на s-орбиталях внешнего и d-орбиталях предвнешнего слоя. Для f-элементов валентными являются (n -2)f- (n - 1)d- и ns-электроны.
2. Уравнение Нернста для электродного процесса.
![]()
В этом
уравнении
![]() - ЭДС реакции, n
- число электронов, участвующих в
электронной реакции, F
-число Фарадея.
- ЭДС реакции, n
- число электронов, участвующих в
электронной реакции, F
-число Фарадея.
Уравнение (7.1) выражает зависимость электродного потенциала от концентрации (активности) ионов и температуры и называется уравнением Нернста для отдельного электрода.
Отметив,
что
![]() - активность окисленной формы реагента
(оф), аМ - активность его восстановленной
формы
(вф), уравнение Нернста можно записать
в следующем виде:
- активность окисленной формы реагента
(оф), аМ - активность его восстановленной
формы
(вф), уравнение Нернста можно записать
в следующем виде:
![]()
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 К, получим удобную для расчетов форму уравнения Нернста:
![]()
Активность твердого вещества (атв) принимается равной единице, поэтому в случае рассматриваемого нами металлического электрода (aM) уравнение Нернста упрощается:
![]()
Потенциал
электрода, как видно из этого уравнения,
зависит от активности ионов
![]() которые являются потенциалопределяющими.
Разность потенциалов стандартного
водородного электрода и какого-нибудь
другого
электрода, измеренная при стандартных
условиях, называется стандартным
электродным
потенциалом
и обозначается Е°.
которые являются потенциалопределяющими.
Разность потенциалов стандартного
водородного электрода и какого-нибудь
другого
электрода, измеренная при стандартных
условиях, называется стандартным
электродным
потенциалом
и обозначается Е°.
Следует подчеркнуть, что:
1 Уравнение Нернста отдельного электрода условились писать для процесса восстановления независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе стоит окисленная форма реагента, в знаменателе - восстановленная.
2 В дробном индексе при Е и Е° над чертой ставится окисленная форма полуэлемента, под чертой -восстановленная.
3 Активности твердых веществ в уравнение Нернста не входят.
3. Напишите вариант реакции замещения для неорганических веществ.
![]()
2 Al
+ 3H2SO4
= Al2(SO4)3
+ 3H2
Al
+ 3H2SO4
= Al2(SO4)3
+ 3H2
Mg + H2SO4 = MgSO4 + H2
Z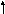 n
+ 2HCL = ZNCl2
+ H2
n
+ 2HCL = ZNCl2
+ H2
Билет № 15
1. Назовите известные вам семейства элементов по таблице Д.И. Менделеева.
Все элементы в таблице расположены по группам и периодам.
Период – это горизонтальный ряд элементов, который начинается типичным щелочным металлом и заканчивается инертным газом. Малые периоды (I, II, III) – состоят из одного ряда, Большие периоды (IV, V, VI, VII) – состоят из двух рядов – четного и нечетного.
По вертикали периодическая система подразделяется на восемь групп. Группы – это вертикальные ряды элементов, они делятся на главные - А, состоящие из s- и p-элементов, и побочные - В-подгруппы, содержащие d-элементы. Подгруппа III В, кроме d-элементов, содержит по 14 4f- и 5f-элементов (4f- и 5f-семейства). Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы.
В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на 5- и p-орбиталях внешнего энергетического уровня, в побочных - на s-орбиталях внешнего и d-орбиталях предвнешнего слоя. Для f-элементов валентными являются (n -2)f- (n - 1)d- и ns-электроны.
2. Уравнение электродного потенциала 1-го рода (на примере металлического электрода).
К электродам первого рода относятся электроды, в уравнение Нернста которых под знаком логарифма входят активности веществ, участвующих в электродной реакции. Потенциал таких электродов меняется с изменением концентрации реагентов.
Электродами первого рода являются:
1. Электроды, состоящие из элементарного вещества, находящегося в контакте с раствором, содержащим его собственные ионы.
а)
Металлический электрод - металл,
погруженный в раствор своей соли М|Мn+,
например, цинковый и медный электроды:![]()
![]()
Металлический электрод обратим по отношению к катиону. Его электродный потенциал
![]()
3. Напишите вариант реакции разложения неорганического вещества.
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
NH4Cl = NH3 + Cl
NH4NO2 = N2 + 2H2O
2Al(OH)3 = Al2O3 + H2O
2HgO 2Hg + O2
Билет № 16
1. Перечислите важнейшие свойства атомов, которые периодически изменяются (пользуясь таблицей Д.И. Менделеева).
Атомный радиус. За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус. При изучении строения молекул и кристаллов атомы и ионы можно рассматривать как имеющие некий эффективный радиус, зависящий от типа химической связи. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента. В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром. В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек.
Образование ионов приводит к изменению ионных радиусов по сравнению с атомными. При этом радиусы катионов всегда меньше, а радиусы анионов всегда больше соответствующих атомных радиусов. Ковалентный радиус равняется половине межатомного расстояния в молекулах или кристаллах простых веществ.
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона.
Энергия ионизации I выражается в кДж-моль-1 или эВ-атом-1. Значение I в электрон-вольтах численно равно потенциалу ионизации, выраженному в вольтах, поскольку Е = е-I.
Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов.
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов
Чем меньше потенциал ионизации, тем легче атом отдает электрон. Поэтому восстановительная способность нейтральных атомов с ростом Z в периоде уменьшается, в главных подгруппах растет, а в побочных — падает.
Другой важной в химии характеристикой атома является энергия сродства к электрону - энергия, выделяющаяся при присоединении электрона к нейтральному атому. Чем больше электронное сродство, тем более сильным окислителем является данный элемент
Немонотонность изменения сродства к электрону в периоде также обусловлена сравнительной устойчивостью полностью и наполовину заполненных подоболочек. Самый сильный из всех элементарных окислителей — фтор (он обладает и самым малым атомным радиусом из всех элементов VII группы).
Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2 и s2р6 и переходные элементы. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Cs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов.
Из анализа периодичности геометрических и энергетических параметров атомов следует, что периодическим законом можно пользоваться для определения физико-химических констант, предсказывать изменение радиусов, энергий ионизации и сродства к электрону, и, следовательно, кислотно-основные и окислительно-восстановительные свойства их соединений.
2. Уравнение электродного потенциала 2-го рода (на примере хлорсеребряного электрода). Типы электродов.
Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
а) Хлорсеребряный электрод (ХСЭ) Аg, АgСl|Сl- представляет собой серебряный проводник, покрытый твердым АgСl, который погружен в насыщенный раствор КСl.
Серебро
электрохимически взаимодействует со
своим ионом:
![]()
Сравнение
Нернста для этого процесса:
![]() (7.2)
(7.2)
Однако в присутствии труднорастворимого AgСl активность ионов серебра очень мала и ее трудно определить. Но активность ионов Ag+ связана с легко задаваемой в данной системе активностью ионов Сl-произведением растворимости хлорида серебра ПРАgСl:
Откуда
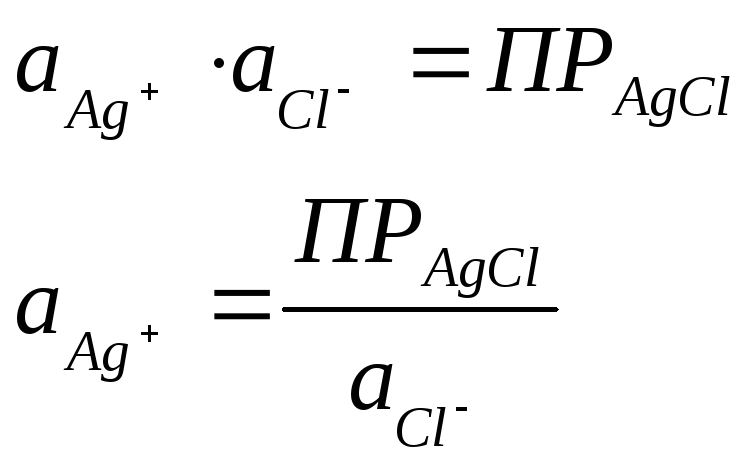
Подставляя
это выражение в (7.2)
![]() ,
,
и
обозначив
![]()
получим
уравнение Нернста для хлорсеребряного
электрода:
![]()
Потенциалопределяющими
являются ионы хлора, а электродный
процесс может быть представлен уравнением
![]()
3. Напишите вариант реакции обмена для неорганических веществ.
2 AgNO3
+ CaCl2 = 2AgCl + Ca(NO3)2
AgNO3
+ CaCl2 = 2AgCl + Ca(NO3)2
B
 aCl2
+ H2SO4 = BaSO4 + 2HCl
aCl2
+ H2SO4 = BaSO4 + 2HCl
C uSO4
+ 2NaOH = Cu(OH)2 + Na2SO4
uSO4
+ 2NaOH = Cu(OH)2 + Na2SO4
NaCl + AgNO3 = AgCl + NaNO3
K 2CO3
+ Ba(NO3)2 = BaCO3 + 2KNO3
2CO3
+ Ba(NO3)2 = BaCO3 + 2KNO3
Билет № 17
1. Как меняется электроотрицательность в группах и подгруппах таблицы Д.И. Менделеева (какие элементы обладают наибольшей и наименьшей электроотрицательностью)?
В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Сs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов.
2. Уравнение потенциала стеклянного электрода.
Ионоселективные электроды (ИСЭ), чувствительные к катионам и анионам, представляют собой электрохимические системы, в которых потенциал определяется процессами распределения ионов между мембраной и раствором.
Исследуемый раствор Мембрана Стандартный раствор
![]()
![]()
![]()
Мембрана разделяет два раствора (исследуемый и стандартный), содержащие ионы, способные проникнуть в мембрану и двигаться в ней. Стандартный раствор содержит только один вид мембраноактивных ионов А+. Состав стандартного раствора неизменен. В настоящее время широко применяются ИСЭ с четко выраженной избирательностью к большому числу катионов и анионов.
Наиболее распространенными ИСЭ являются стеклянные электроды. Стекло рассматривается как твердый электролит, способный вступать в ионное взаимодействие с раствором. Стекла, содержащие катионы Na, Li, Сa, обладают сродством к ионам Н+ , введением в сое гав стекла оксидов Аl и В удалось создать ИСЭ для ионов Na+,К+ ,NH4+, Li+, Аg+, Тl+ и др.
Стеклянный электрод для определения концентрации Н+ состоит из стеклянного тонкостенного шарика, ан+ = 0,1 припаянного к стеклянной трубке. В шарик налит раствор HCl (внутренний раствор. Моль*л-1), в который опущен хлорсеребряный электрод. При погружении стеклянного электрода в раствор с измеряемой концентрацией Н+ (внешний раствор) между мембраной и исследуемым раствором (р) происходят процессы ионного обмена:
![]()
приводящие к разности потенциалов.
Сравнительный электрод Исследуемый раствор Мембрана Стандартный p-p
![]()
![]()
![]()
![]()
Потенциал стеклянного электрода равен
Стеклянные электроды обычно используют для определения рН.
Водородный электрод, выбранный за нулевую точку при сравнении электродных потенциалов, в качестве рабочего электрода сравнения практически не используется. Это связано со многими конструкционными, технологическими и эксплуатационными трудностями: газообразный водород очень критичен даже к малейшим примесям, его давление должно строго соответствовать 100 кПа, а активность ионов водорода в растворе - строго соответствовать единице, поверхность платинового электрода должна быть чистой и сохранять каталитические свойства в течение долгого времени. Поэтому в качестве электродов сравнения обычно используют лишенные этих неудобств электроды второго рода: чаще других хлорсеребряный (ХСЭ) и каломельный (КЭ), так как при постоянной концентрации ионов хлора их потенциалы остаются постоянными. Кроме ХСЭ и КЭ очень удобным в работе оказался стеклянный электрод.
Если гальванический элемент составлен из полу элементов сравнения, то он обладает высокой стабильностью, его ЭДС не меняется многие годы.
3. Напишите вариант реакции взаимодействия простых веществ, приводящего к образованию соли.
2K + S = K2S
N a
+ Cl = NaCl
a
+ Cl = NaCl
Cu + S = CuS
K + Cl = KCl
Li + S = Li2S
Билет № 18
1. Назовите как можно больше элементов, относящиеся к металлам и неметаллам.
В периодической системе Д. И. Менделеева металлы занимают левый нижний угол. Это связано е закономерностями изменения в периодах и группах. Так в периодах слева направо металлические свойства падают, неметаллические - возрастают. Значит металлы должны находиться в начале периодов. В группах сверху вниз неметаллические свойства элементов падают, а металлические - возрастают. Следовательно, металлы должны находиться в конце групп. Отсюда следует, что металлы в целом занимают нижний левый угол таблицы, а неметаллы - верхний правый.
Металлы
Щелочные металлы - металлы главной подгруппы I группы
Металлы главной подгруппы II группы
Неметаллы
Подгруппа кислорода О - S - Sе - Те - Рo
Подгруппа азота N - Р - Аs – Sb - Вi
Подгруппа углерода С - Si - Gе - Sn - Рb
2. Уравнение зависимости константы равновесия и ЭДС для электрохимической реакции.
Между ЭДС электрохимического элемента, константой равновесия электрохимической реакции и активностями реагентов существует зависимость. Рассмотрим окислительно-восстановительную реакцию,
аА+bВ=сС+dD
протекающую обратимо в электрохимическом элементе, и найдем для этого
элемента значение ЭДС (Е). Обозначим активности реагирующих веществ
через aA, aB, aC, aD. Согласно уравнению изотермы химической реакции энергия
Гиббса этой реакции равна:
-ΔG = R*T(lnKa – ln((aCc * aDd)/( aAa * aBb)))
где Ка – константа равновесия; aC, aD, aA, aB, - начальные (неравновесные) активности реагентов. Учитывая формулу:
-ΔG = Wm’ = n*F*Еэ
получаем термодинамическое выражение для ЭДС элемента:
Eэ = ((R*T)/(n*F))*(lnKa – ln((aCc * aDd)/( aAa * aBb)))
ЭДС элемента, относящуюся к стандартным условиям, когда aA=aB=aC=aD =1, обозначают Е0 и называют стандартной ЭДС. При активностях участников реакции равных единице, из последней формулы получим:
Eo = bo/n*lnKa, где
bo = R*T/F= 8,61*10-4 T
при 298 К b0=0,0258 В.
3. Напишите вариант реакции нейтрализации слабой неорганической кислоты сильным неорганическим основанием.
NaOH + HI = NaI + H2O
Ca(OH)2 + 2HBr = CaBr2 + 2H2O
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Билет № 19
1. Что такое «химическая связь», как ее изображают в формулах и какие типы химической связи бывают?
Химический связь - это совокупность сил. действующих между атомами или группой атомов, приводящее к образованию устойчивой многоатомной системы.
Типы химической связи:
• Ковалентная связь
• Ковалентная неполярная связь (гомеополярная)
• Ковалентная полярная связь (гетерополярная)
• Ионная связь
• Металлическая связь
• Водородная связь
Изображение химической связи (пример):
H : N : H + Н H : N : Н
2. Напишите формулу расчета массовой или объемной доли растворенного вещества.
массовая доля – отношение масса растворенного вещества к массе раствора (т.е. отношение массы компонента X к массе всей системы)
w(X)=m(X)/m
измеряется в %
Объемная доля - отношение числа молей данного компонента (n1) к сумме молей данного компонента и всех других компонентов раствора (растворителя и других растворенных веществ (n2).
3 .
Напишите
вариант реакции получения соли
взаимодействием другой соли и кислоты.
.
Напишите
вариант реакции получения соли
взаимодействием другой соли и кислоты.
Na2Co3 + 2HNO3 = 2NaNO3 + H2O + CO2
K 2CO3
+ 2HCl = 2KCl + H2O + CO2
2CO3
+ 2HCl = 2KCl + H2O + CO2
N a2CO3
+ 2HCl = 2NaCl + H2O + CO2
a2CO3
+ 2HCl = 2NaCl + H2O + CO2
C
 aCO3
+ HCl = CaCl2 + H2O + CO2
aCO3
+ HCl = CaCl2 + H2O + CO2
N a2SiO3
+ H2SO4 = Na2SO4 + H2SiO3
a2SiO3
+ H2SO4 = Na2SO4 + H2SiO3
Билет № 20
1. Дайте определение терминам: длина, угол и энергия связи, что определяет и чем характеризуется прочность химической связи?
Количество энергии, выделяющейся при образовании химической связи, называется энергией связи. Эта величина является важнейшей характеристикой прочности связи, ее выражают в килоджоулях на 1 моль образующегося вещества. Мерой прочности связи служит энергия, затрачиваемая на разрушение связи, или выигрыш в энергии при образовании соединения из отдельных атомов (Есв). Так, на разрыв связи Н-Н затрачивается 435 кДж-моль-1, а на атомизацию метана СН4 - 1648 кДж-моль-1, в этом случае ЕС-Н = 1648 : 4 = 412 кДж. Длина связи (нм) - расстояние между ядрами в том или ином соединении. Обычно длина связи и ее энергия антибатны: чем больше длина связи, тем меньше ее энергия. Угол связи – угол между связями атомов в молекуле.
2. Напишите формулу расчета мольной доли растворенного вещества. Какие еще бывают доли?
Мольная доля растворенного вещества х(В) выражается соотношением
![]() или
или
![]()
![]()
(это количество
растворенного вещества к сумме количеств
молей раствора). Сумма мольных долей k
компонентов раствора
![]() равна единице. 1/1000% - «промилле»
равна единице. 1/1000% - «промилле»
Также существуют массовая и объёмная доли.
3 .
Напишите
вариант реакции получения соли
взаимодействием другой соли и щелочи.
.
Напишите
вариант реакции получения соли
взаимодействием другой соли и щелочи.
CuCl2 + 2NaOH = 2NaCl + Cu(OH)2
C r2(SO4)3
+ 6KOH = 2Cr(OH)3 + 3K2SO4
r2(SO4)3
+ 6KOH = 2Cr(OH)3 + 3K2SO4
C uSO4
+ 2NaOH = Cu(OH)2 + Na2SO4
uSO4
+ 2NaOH = Cu(OH)2 + Na2SO4
NaCl + KOH = KCl + NaOH
AlCl3 + 3KOH = 3KCl + Al(OH)3
