
- •Рабочая учебная программа по дисциплине
- •Цель и задачи дисциплины
- •Тематическое содержание дисциплины
- •Тематика курсовых работ и методические указания по их выполнению.
- •Самостоятельная работа.
- •Литература
- •Информационное обеспечение дисциплины
- •Методические указания для студентов
- •1.1.Уравнение состояния газов.
- •1.2. I. Законы термодинамики.
- •1.3. Второй закон термодинамики. Энтропия.
- •Лекция №2.
- •1.4. Исследование основных термодинамических процессов идеальных газов в закрытых системах.
- •Лекция №3.
- •Лекция №4
- •Понятие об условном топливе,
- •Топочные устройства.
- •Общие сведения о котельных установках.
- •Лекция№ 5 теплопроводность твёрдых тел.
- •Способы передачи теплоты.
- •Закон фурье и коэффициент теплопроводности.
- •Перенос теплоты в режиме естественной и вынужденной конвекции. Понятие о теории подобия в теплотехнике. Введение.
- •Физические свойства жидкостей.
- •Краткие сведения из гидродинамики.
- •Подобие и моделирование процессов конвективного теплообмена.
- •Лекция №6 лучистый теплообмен. Понятие сложного теплообмена. Термическое сопротивление ограждающих конструкций здани
- •Основные законы лучистого теплообмена.
- •Термическое сопротивление наружных ограждений зданий.
- •Лекция №7 Современные системы отопления. Гигиенические требования. Классификация систем отопления.
- •Лекция №8
- •Лекция №9. Гигиенические основы вентиляции. Способы организации воздухообмена.
1.1.Уравнение состояния газов.
Аналитическая
зависимость между параметрами состояния
системы называется уравнением состояния.
Для простого тела уравнение состояния:
![]()
Этому уравнению простого тела можно придать следующий вид:
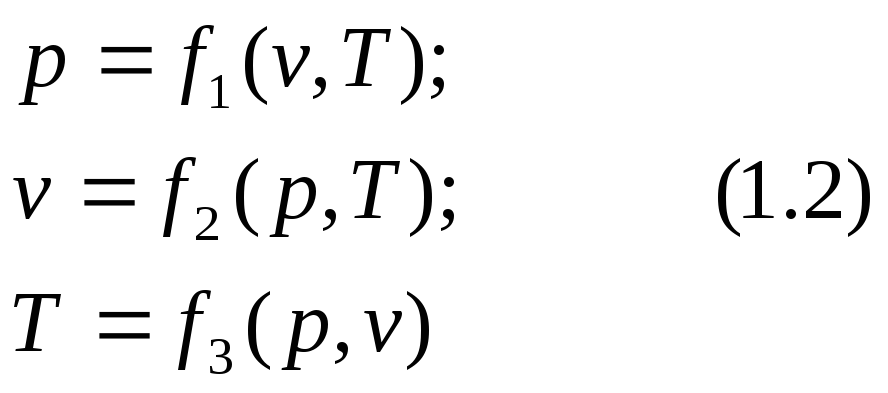
Данные уравнения называют уравнениями состояния простого тела. В термодинамике рассматриваются процессы: изохорный, изотермический, изобарный, адиабатный, политропный. Политропный процесс является обобщающим. Диаграммы круговых процессов (циклов) часто используются в термодинамике для наглядного представления положительной работы двигателей. Идеальный газ можно представить как систему материальных частиц, не обладающих объёмом и силами молекулярного взаимодействия.
В реальных газах имеет место межмолекулярное взаимодействие, а также нельзя пренебрегать собственным объёмом молекул. Реальные газы близки к идеальным, если они находятся в состоянии разрежения или давлении не превышающим атмосферное.
Уравнение состояния идеального газа было получено Клапейроном в 1834 г. и имеет вид:
![]()
Для 1 киломоля газа уравнение получено Менделеевым Д.И.:
![]()
Объём 1 киломоля
любого газа равен 22,4146 нм![]() ,
р=101325 Па, T=273,15К,
,
р=101325 Па, T=273,15К,
Соответственно универсальная газовая постоянная –
![]()
Уравнение состояния, приближённо отражающее свойства реальных газов:
![]()
носит название уравнения Ван-дер-Ваальса, где «а» и «b» const.
1.2. I. Законы термодинамики.
Первый закон
термодинамики – частный случай всеобщего
закона природы, т.е. закона сохранения
и превращения энергии применительно к
тепловым процессам. Если газу сообщить
количество теплоты dQ,
то часть её идёт на изменение энергии
газа dU
(внутренняя энергия), а другая часть на
совершение работы dL
против сил внешнего давления «р».
Перемещение поршня dx,
элементарная работа:
![]()

интегрируя данное
выражение в пределах от V![]() до V
до V![]() ,
находим работу:
,
находим работу:

Обычно в термодинамике
используют удельные значения
соответствующих величин, т.е.

здесь
v-![]() удельный объём рабочего тела.
удельный объём рабочего тела.
Данные соотношения
справедливы для равновесных процессов,
однако с известной долей приближения
их используют для практических
термодинамических расчётов. Для простого
тела внутренняя энергия функция двух
параметров: u=f![]() (р,T);
u=f
(р,T);
u=f![]() (р,v);
u=f
(р,v);
u=f![]() (v,T)
(1.9).
(v,T)
(1.9).
Таким образом, первый закон термодинамики можно сформулировать в такой редакции – теплота, которой обменивается термодинамическая система с окружающей средой, равна изменению внутренней энергии этой системы и работе, совершаемой в процессе изменения состояния термодинамической системы, т.е. dq=du+рdv (1.10)
Полная теплоёмкость системы равна:
![]()
На практике
пользуемся понятием удельной теплоёмкости.
Различают удельную массовую, объёмную,
мольную теплоёмкости. Изохорная
теплоёмкость с![]() определяет скорость изменения внутренней
энергии системы при T=var
в процессе v=const.
Для изобарного процесса теплоёмкость
с
определяет скорость изменения внутренней
энергии системы при T=var
в процессе v=const.
Для изобарного процесса теплоёмкость
с![]() найдём воспользовавшись выражением:
найдём воспользовавшись выражением:
![]() разделив это
выражение на dT
разделив это
выражение на dT
Получим:
![]() т.к. «u»
не зависит от объёма «v»,
т.к. «u»
не зависит от объёма «v»,
поскольку отсутствуют
силы межмолекулярного взаимодействия,
т.е.
![]() кроме того
кроме того
![]() ,
соответственно
,
соответственно
![]() ,
это уравнение Майера. Для реальных газов
,
это уравнение Майера. Для реальных газов
![]() .
Среднее значение теплоёмкости в
определённом интервале температур
определяется из выражения:
.
Среднее значение теплоёмкости в
определённом интервале температур
определяется из выражения:
![]()
В термодинамических расчётах часто используется вспомогательная функция – энтальпия «H» . Данная функция равна сумме «U» и произведения давления на объём термодинамической системы, Дж, т.е.:
H=U+рV
U, р, V- функции состояния термодинамической системы, следовательно, «H» - также функция состояния. Таким образом, изменение энтальпии в термодинамическом процессе не зависит от пути процесса и может быть представлена в виде функции двух любых параметров состояния простого тела:
![]() ,
где
,
где
![]()
![]() удельная
энтальпия
удельная
энтальпия
h=u+рv,
т.к. рdv=d(рv)-vdр,
тогда dq=d(u+рv)-vdр=dh-vdр,
при р=const,
dq![]() =dh.
=dh.
Таким образом элементарное изменение энтальпии:
![]()
