
- •М. Бровари 2011р. Перелік умовних скорочень
- •Розділ 1 антибіотики ряду цефалоспорини
- •Розділ 2 Роль нормальної мікрофлори у функціонуванні товстої кишки
- •Розділ 3 антибіотик-асоційована діарея
- •Можна виділити 2 можливі механізми аад:
- •1. Прямий - через регуляцію активності іон-селективних каналів, а саме цАмф-залежних хлор-селективних каналів cftr та аквапоринових каналів, що відповідають за транспорт води;
- •Розділ 4 матеріали, обєкт і методи дослідження
- •Результати та їх обговорення
- •Висновки
- •Список використаних джерел
Результати та їх обговорення
Визначення чутливості мікрофлори зіва людини до різних груп антибактеріальних препаратів
Кожна людини – індивідуальна і це стосується не лише її характеру, кольору очей, волосся, а також її чутливості до дії антибактеріальних препаратів. Сучасна медицина направлена на індивідуальний підхід до кожного пацієнту. Розшифрування геному людини стало революційним у цьому напрямку, адже нуклеотидна послідовність кожного гену несе в собі безліч інформації про схильність до різних груп захворювань, про стан імунної системи і т.д. Вплив факторів навколишнього середовища призводить до необоротних змін у геномі людини і може бути причиною виникнення смертельних хвороб впродовж її життя.
Хвороботворні бактерії, що оточують людину у повсякденному житті виробляють резистентність (нечутливість) до дії різних груп антибактеріальних препаратів. На сьогодні це є дуже серйозною проблемою для лікарів. Існують випадки, коли мутаційні зміни бактерій відбувалися настільки швидко, що це призводило до летальних випадків. Тому визначення індивідуальної чутливості кожної окремої людини до антибактеріальних препаратів є першочерговим етапом у лікуванні інфекційних хвороб.
Ми провели визначення чутливості мікрофлори з зіву 3-х учнів віком 14-15 років (1 дівчина, 2 хлопця) до антибіотиків групи цефалоспоринів (цефтріаксон), та пеніцилінів (пеніцилін). Це бета-лактамні антибіотики, механізм дії яких опосередковується через їх зв’язування з, так званими, пеніцилін-зв’язуючими білками, які є ферментами синтезу бактеріальної стінки. Ці антибіотики найбільш широко застосовуються в клінічній практиці. Серед бета-лактамів перше місце обіймають пеніцилліни (більше половини всіх призначень), далі ідуть цефалоспорини [Березняков И.Г. Ингибиторозащищенные цефалоспорины: перспективы клинического применения // Медицина неотложных состояний. – 2006. – Т.6, № 7. – С. 12-17].
В результаті проведених досліджень було виявлено, що мікрофлора всіх досліджуваних не мала чутливості до пеніциліну (табл. 1).
Таблиця 1. Значення чутливості мікрофлори з зіву до антибіотиків групи цефалоспоринів (цефтріаксон), та пеніцилінів (пеніцилін)
|
Учні |
Зона затримки росту (мм) |
|
|
Пеніцилін |
Цефтріаксон |
|
|
1 |
0 |
15 |
|
2 |
2 |
16 |
|
3 |
4 |
20 |
.
Пеніцилін був першим антибіотиком, за відкриття якого Александер Флемінг отримав Нобелівську премію 1945 р. Широке застосування цього класу антибіотиків призвело до розвитку надбаної резистентності, яка розвивається в результаті мутацій чи при передачі генів, що кодують резистентність від резистентних бактерій до чутливих бактерій. Результати наших досліджень підтверджують наявність резистентності мікрофлори досліджуваних учнів до пеніциліну.
С клінічної точки зору найбільш важливим механізмом захисту бактерій є їх здатність синтезувати ферменти, що руйнують антибіотики. Бактеріальні ферменти, що руйнують бета-лактамні антибіотики - бета-лактамази. Для перешкоджання дії бета-лактамаз бактерій і збереження антибактеріальної діі були синтезовані антибіотики захищенні інгібіторами бете-лактамаз, до яких належить цефтріаксон. Проведені нами дослідження показали, що мікрофлора всіх досліджуваних учнів мала середню чи високу чутливість до дїі цефтріаксону (табл. 1).
***
Таким чином, ми можемо зробити висновки:
-
Застосування антибіотиків лише за призначенням лікаря. Неконтрольована антибіотикотерапія може призвести до розвитку резистентності бактерій.
-
Для боротьби з інфекційними хворобами потрібно застосовувати сучасні схеми лікування, адже резистентність бактерій постійно підвищується до широковживаних антибіотиків. Застосування неефективних антибіотиків не вилікує хвороби, але може призвести до порушення складу нормальної мікрофлори людини.
Дослідження впливу цефтріаксону на мікробіоциноз товстої кишки щурів
Моніторинг клінічного стану щурів на фоні 5-ти добового введення цефтріаксону
В ході експерименту проводили моніторинг клінічного стану щурів за такими показниками: маса тіла та характер випорожнень.
Перед початком введення антибіотико чи фізіологічного розчину (контрольна група) та в кінці експерименту (через день після останнього введення) щурів контрольної та дослідної груп зважували. Ми не спостерігали різниці у масі тіла щурів на початку і в кінці експерименту.
Слід відзначити, що клінічно у 30% щурів, які отримували цефтріаксон, розвивалась діарея. Рідкі випорожнення з’являлись переважно на 2-3 добу від початку терапії і зберігались протягом декількох днів незалежно від тривалості антибактеріальної терапії.
Визначення змін у просвітній та пристінковій мікрофлорі кишечника щурів в нормі та в різний термін після терапії з цефтріаксоном
Мікрофлора кишечника у функціональному відношенні ділиться на дві основні групи: пристінкову і просвітну. Просвітна або транзиторна мікрофлора входить до складу фекальної мікрофлори. Її основними представниками є аеробні та факультативно аеробні мікроорганізми, в основному представники сімейства Enterobacteriaceae. Склад просвітної мікрофлори непостійний і варіює залежно від характеру харчування, якості харчових продуктів, функціонального стану кишечника, частоти стільця. Пристінкова або "фіксована" мікрофлора на 99% представлена неспороутворюючими анаеробними та факультативно-анаеробними бактеріями (біфідо-і лактобактерії, бактероїди, молочнокислі стрептококи та ін), які прикріплені до поверхневих рецепторів епітеліальних клітин. Пристінкова мікрофлора більш стабільна, представляє собою стійку систему, зруйнувати яку досить важко. Тому некоректно судити про зміни в мікробному ценозі тільки за результатами бактеріологічного дослідження фекалій. У зв'язку з цим, ми також дослідили зміни в пристінковій мікрофлорі.
На першому етапі роботи ми провели порівняння кількісного складу просвітної мікрофлори, яку ми визначали за результатами посіву фекалій, та пристінкової мікрофлори. Для визначення пристінкової мікрофлори у щурів видаляли 1 см товстої кишки, гомогенізували. Отриманий гомогенат висівали на поживне середовище. Як видно з таблиці 2, рівень біфідобактерій, лактобактерій і умовно-патогенних ентеробактерій був значно нижчим в пристінковій, у порівнянні з просвітною мікрофлорою.
Таблиця 2. Порівнянні кількісного складу просвітної та пристінкової мікрофлори товстої кишки щурів за нормальних умов
|
Групи мікроорганізмів |
Мікрофлора |
|
|
Просвітна (lg КУО/г) |
Пристінкова (lg КУО/см2) |
|
|
Біфідобактерії |
8,7 + 0,3 |
5,3 + 1,0 |
|
Лактобактерії |
6,3 + 0,4 |
2,0 + 0,9 |
|
Умовно-патогенні ентеробактерії |
2,0 + 0,2 |
1,4 + 0,8 |
Наступним етапом нашої роботи було визначити зміни у нормофлорі товстої кишки щурів після 5-ти добового введення цефтріаксону в дозі 50 мг/кг. Цефтріаксон зумовлював значні зміни у кількісному складі просвітної мікрофлори. Це проявлялося у зниження числа біфідобактерій з 8,7 + 0,3 lg КУО/г в контрольній групі до 7,7 + 0,8 lg КУО/г в групі, що отримувала цефтріаксон. Такж спостерігалася тенденція до зниження у рівні лактобактерій, показники яких у контрольних щурів становили 6,3 + 0,4 lg КУО/г, у щурів дослідної групи - 5,0 + 1,5 lg КУО/г. Зниження рівня факультативних-анаеробних бактерій супроводжувався збільшенням, майже у два рази рівня умовно-патогенних ентеробактерій. Так в контрольній групі їх рівень становив 2,0 + 0,2 lg КУО/г, тоді як після введення цефтріаксону він зріс до 4,0 + 1,0 lg КУО/г (рис.1).
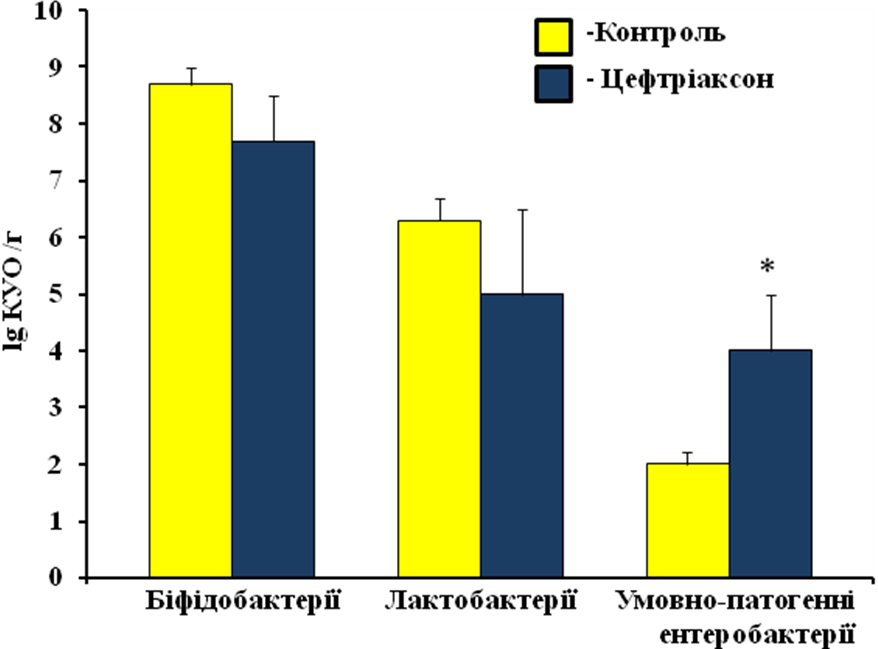
Рис. 1 Вплив цефтріаксону (50 мг/кг, в.м.) на просвітну мікрофлору товстої кишки щурів. *- P<0,05, відносно показників в контрольній групі.
Введення ценфтріаксону щурам також справляв зсув у складі пристінкової мікрофлори, хоча зміни були не такі виразні як у складі просвітної мікрофлори. Найбільш виразним було зменшення у числі біфідобактерій. Так в контрольній групі їх рівень становив 5,3 + 1,0 lg КУО/см2, тоді як після введення цефтріаксону він зменшився до 4,0 + 0,3 lg КУО/ см2. Рівень лактобактерій у контрольних щурів становили 2,0 + 0,9 lg КУО/ см2, у щурів дослідної групи - 2,4 + 0,3 КУО/ см2. Кількісний склад умовно-патогенних ентеробактерій також був без змін і становив 1,4 + 0,8 lg КУО/ см2 у контрольних щурів та 1,0 + 0,5 lg КУО/ см2 після введення цефтріаксону (рис.2).
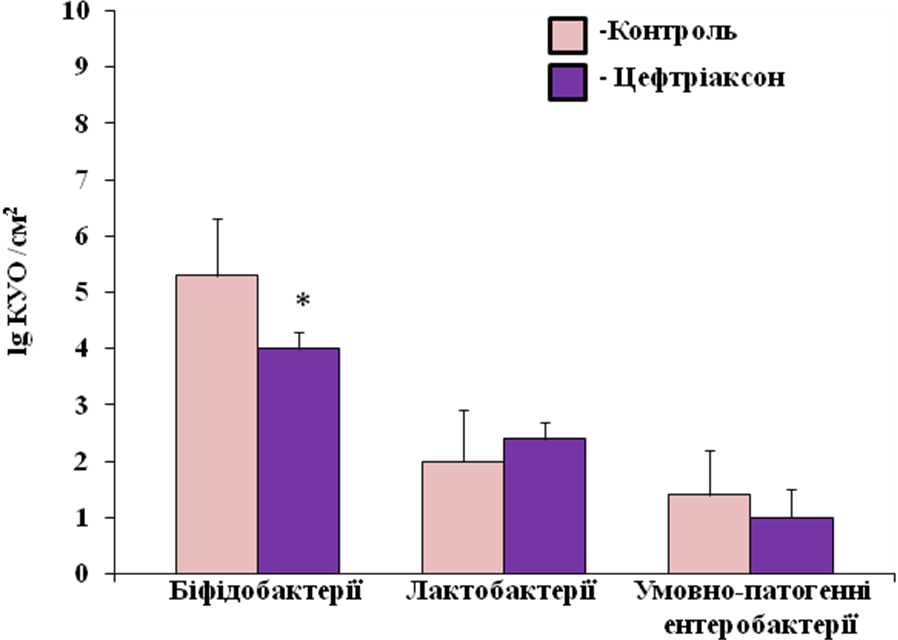
Рис. 2 Вплив цефтріаксону (50 мг/кг, в.м.) на пристінкову мікрофлору товстої кишки щурів. *- P<0,05, відносно показників в контрольній групі.
Аналізуючи отримані результати можна заключити, що введення цефтріаксону призводить до змін у нормо флорі товстої кишки щурів, що відповідають І-ІІ ступені дисбактеріозу.
-
Згідно класифікації кишкового дисбактеріозу за Грачовою Н.М. та співавт. дисбактеріоз I ступеня (латентна, компенсована форма) характеризується незначними змінами аеробної частини мікробіоценозу (збільшення або зменшення кількості кишкової палички). Біфідо- та лактофлора залишаються незмінними. Кишкові дисфункції, як правило, не реєструються;
-
дисбактеріоз II ступеня (субкомпенсована форма). На фоні незначного зниження вмісту біфідофлори виявляються кількісні та якісні зміни кишкової палички або інших умовнопатогенних мікроорганізмів. Така форма дисбактеріозу є граничним станом і свідчить про те, що досліджувані особи можуть бути віднесені до групи ризику;
