

I. Постановка задачи
Целью работы является углубление знаний по теории теплоемкости, изучение методики опытного определения теплоемкости газов в изобарном процессе методом проточного калориметрирования и получение навыков в проведении эксперимента.
К выполнению работы следует приступить после проработки следующей литературы:
1. Техническая термодинамика. Под ред. В. И. Крутова. - М.: Высшая школа, 1971, с.116-126.
2. Зубарев В.Н., Александров А.А. Практикум по технической термодинамике,- М.: Энергия, 1971, с. 23-132, с. 226-232.
Продолжительность работы -2 ч, домашняя работа -2 ч.
2. Теоретические основы
При сообщении телу бесконечно малого количества теплоты δQ температура его изменяется на бесконечно малую величину dT; теплоемкостью С тела называют отношение этих величия, т.е.
![]()
В практике расчетов значение имеют удельные теплоемкости, т.е. теплоемкости, отнесенные к какой-либо количественной единице тела.
Рассматривая удельную теплоемкость для газообразных рабочих тел, следует отметить, что величина ее зависит от природы рабочего тела, от количественной единицы, к которой ее относят, от характера процесса теплообмена и от параметров состояния рабочего тела.
Таким образом, удельная теплоемкость численно равна количеству теплоты, которое необходимо сообщить какой-то количественной единице рабочего тела, чтобы в данном процессе и пря данных его параметрах изменять температуру этого тела на I К.
Различают массовую С (кДж/(кг∙К)), объемную С`(кДж/(м3∙К)) и мольную Сμ (кДж/(моль∙К)) удельные теплоемкости (я дальнейшем для краткости слово "удельная" будем опускать). Тогда истинная (т.е. для данных параметров рабочего тела) массовая теплоемкость в каком-то процессе s=Const может быть вычислена как
Если процесс s=Const конечный, т.е. в процессе подведено конечное количество теплоты qs и изменение температуры dT также конечное, то иногда целесообразно получить значение средней теплоемкости:
![]() или
или
![]() ,
,
где m - масса рабочего тела в кг; Qs - количество подведенной к телу теплоты.
Из всего множества теплоемкостей, соответствующих различным встречающимся на практике процессам, для термодинамического анализа и теплотехнических расчетов имеют особое значение теплоемкости в процессах при постоянном объеме Сv и при постоянном давления Ср.
Значения теплоемкостей для наиболее важных рабочих тел определяется экспериментально. Наиболее просто определяется изобарная теплоемкость Ср. Экспериментальное определение изохорной теплоемкости Сv в силу ряда причин является более сложным. Но при известном Ср и p , υ, Т - для данного рабочего тела Сv может быть рассчитана при помощи дифференциальных уравнений термодинамики.
Изобарную теплоемкость газов и паров почта всегда определяют путем проточного калориметрирования. Для этого к газу, проходящему через проточный калориметр, подводят теплоту, например, при помощи электронагревателя. Измеряют расход газа, количество подведенной теплоты, температуры газа на входе в калориметр и выходе из него (рис.1).
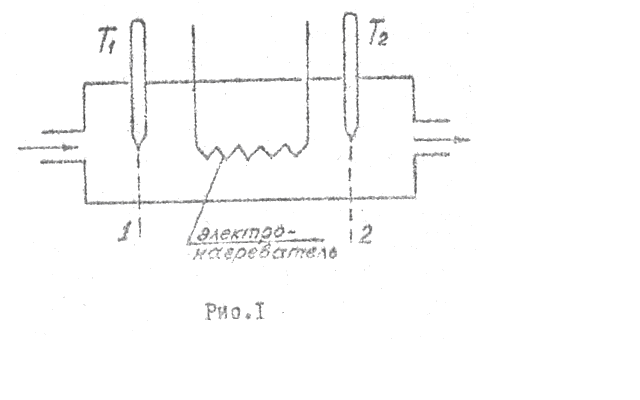
При установившемся режиме течения газа через калориметр для сечений 1 и 2 можно записать уравнение первого закона термодинамики для потока
![]() (1)
(1)
Здесь qэл - теплота, подведенная от электрического нагревателя к 1 кг проходящего газа; qтп - тепловые потеря в окружающую среду, отнесенные к 1 кг газа.
Скорости W1 и W2 незначительно отличаются друг от друга, техническая работа lтех , а H2=H1, так как калориметр расположен горизонтально.
Тогда уравнение (I) перепишется так:
![]() (2)
(2)
В общем случае энтальпия газа зависит от температуры и давления и
![]() (3)
(3)
Воздух при атмосферном давлении по своим свойствам близок к идеальному газу. Уравнение состояния идеального газа pυ=RT, следовательно второй член в правой части уравнения (3) равен нулю. Т.е. вместо уравнения (3) будет
![]() (4)
(4)
или, для конечного изменения температуры,
![]() (5)
(5)
Здесь Срср - средняя массовая теплоемкость воздуха при изобарном процессе в интервале температур опыта.
Подставляя разность энтальпий из (5) в (2) и решая относительно Срср, получим:
![]() (6)
(6)
Поскольку в эксперименте теплота определяется в единицу временя (за 1 с ), то
![]() (7)
(7)
где m (кг/с) - секундный расход газа через калориметр.
Формулой (7) и будем пользоваться при обработке экспериментальных данных.
Следует помнить, что для реальных газов приходится учитывать зависимость энтальпии от давления (уравнение (3)), и формула для расчета теплоемкости усложняется.
