
- •Первый закон термодинамики. Термодинамические функции состояния. Внутренняя энергия и энтальпия. Энтальпия образования химического состояния.
- •Термохимия. Закон Гессе и следствие из него.
- •2) Термохимия. Закон Гесса и следствие из него.
- •3) Второй закон термодинамики. Энтропия, как мера неупорядоченности системы.
- •4) Энергия Гиббса как критерий вероятности самопроизвольного протекания процесса. Энтальпийная и энтропийная составляющие энергии Гиббса.
- •5) Химическое равновесие. Константа равновесия и её связь с энергией Гиббса.
- •6) Смещение химического равновесия. Принцип Ле-Шателье.
- •7) Растворы неэлектролитов. Осмос, осмотическое давление. Закон Вант-Гоффа.
- •8) Растворы неэлектролитов. Закон Рауля и следствия из него.
- •10) Константа и степень диссоциации слабых электролитов. Закон разбавления Оствальда. Ступенчатая диссоциация.
- •11)Свойства растворов сильных электролитов. Ионная сила раствора, коэффициенты активности и активности ионов. Уравнение Деббая-Гюккеля.
- •11)Свойства растворов сильных электролитов. Ионная сила раствора, коэффициенты активности и активности ионов. Уравнение Деббая-Гюккеля.
- •12) Диссоциация воды. Константа диссоциации. Ионное произведение воды. Водородный и гидроксильный показатели.
- •13) Гидролиз солей. Три случая гидролиза солей. Константа и степень гидролиза.
- •14 Окислители и восстановители. Типы окислительно-восстановительных реакций.
- •15)Электрохимические процессы. Окислительно-восстановительные потенциалы. Уравнение Эрнста.
- •16) Направление протекания окислительно-восстановительных реакций. Вычисление константы равновесия окислительно-восстановительных реакций.
- •17) Превращение энергии окислительно-восстановительной реакции в электрическую. Гальванический элемент. Концентрационный гальванический элемент.
- •18) Обратимые гальванические элементы. Аккцмуляторы.
- •19) Коррозия металлов. Виды коррозии: химическая и электрохимическая. Механизм протекания электрохимической коррозии.
- •20) Коррозия металлов. Основные окислители при электрохимической коррозии. Коррозия в кислой, нейтральной и щелочной средах.
- •21) Способы защиты металлов от коррозии: защитные покрытия, использование ингибиторов, электрохимическая защита от коррозии. Процессы, протекающие на электродах при коррозийном разрушении металлов.
16) Направление протекания окислительно-восстановительных реакций. Вычисление константы равновесия окислительно-восстановительных реакций.
О направлении ОВР можно судить по изменению энергии Гиббса ∆G. Если ∆G < 0 – реакция возможна, если ∆G > 0 - невозможна. Из термодинамики известно, что ∆G = -n·F·E; E = φок-ля -φв-ля или φок-ля > φв-ля, что возможно при Е > 0 и ∆G < 0.
Рассмотрим реакцию:
![]()
Она состоит из двух полуреакций:
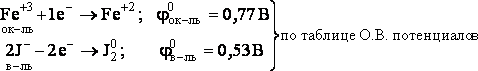
Т.к. φок-ля > φв-ля, то возможно самопроизвольное протекание реакции слева направо.
2FeCl3 + 2KJ → 2FeCl2 + J2 + 2KCl
Из всех возможных при данных условиях О.В.Р. в первую очередь протекает та, которая имеет наибольшую разность окислительно – восстановительных потенциалов.
О.В.Р. протекают в сторону образования более слабых окислителей и восстановителей из более сильных.
ВЫЧИСЛЕНИЕ КОНСТAHТ РАВНОВЕСИЯ ДЛЯ ОКИСЛИТЕЛЬНО-ВОССТAHОВИТЕЛЬНЫХ РЕАКЦИЙ
Выше было указано, что электродный потенциал полуэлемента несколько изменяется в зависимости от концентрации ионов в растворе. Если записать уравнение электродной полуреакции в общем виде следующим образом:
Окисленные частицы + ze -> восстановленные частицы
то соотношение
между концентрацией и электродным
потенциалом определяется уравнением
Нернста
![]()
где R-молярная газовая постоянная, T-абсолютная температура, z—число электронов, присоединяемых к окисленным частицам при образовании восстановленных частиц, F-заряд одного моля электронов (фарадей), Е°-стандартный электродный потенциал и In - натуральный логарифм.
Применим уравнение Нернста, в качестве примера, к гальваническому элементу Даниэля. Как было показано выше, на левом электроде элемента Даниэля протекает следующая полуреакция:
![]()
Окисленными
частицами являются ионы Zn2+(вода.), а
восстановленными - атомы Zn(TB.). Для этого
электрода уравнение Нернста записывается
так:

Уравнение полуреактга
на правом электроде имеет вид
![]()
для этого электрода
уравнение Нернста таково:
![]()
Эти два уравнения Нернста можно скомбинировать, и в результате получится соотношение, определяющее зависимость э.д.с. гальванического элемента от концентрации ионов в каждом из полуэлементов. Поскольку

(Напомним, что In х = 2,303 Lg х).
Когда окислительно-восстановительная реакция, протекающая в элементе Даниэля, достигает положения равновесия, э.д.с. этого источника тока становится равной нулю. Это позволяет записать

авновесие
окислительно-восстановительной реакции,
протекающей в элементе Даниэля,
описывается уравнением
![]()
Константа этого
равновесия определяется выражением
![]() Подставляя это выражение в полученное
выше уравнение, получим
Подставляя это выражение в полученное
выше уравнение, получим
![]()
При стандартных условиях коэффициент 2,303RTfF численно равен 0,059 В*. Это позволяет записать
![]()
Таким образом, мы получили уравнение, которое связывает стандартную э.д.с. элемента Даниэля с константой равновесия окислительно-восстановительной реакции, протекающей в этом элементе. Аналогичные уравнения можно вывести и для других окислительно-восстановительных реакций. На использовании подобных уравнений основан простой способ нахождения констант равновесия окислительно-восстановительных реакций путем экспериментального определения стандартных электродных потенциалов.
Например, для элемента Даниэля стандартная э.д.с. равна 1,10 В. Значит,

Большое численное значение константы равновесия указывает на то, что реакция протекает практически до полного завершения.
