
6 Сравнительная характеристика
ОДНОТИПНЫХ СОЕДИНЕНИЙ ГАЛОГЕНОВ
6.1 Х а р а к т е р и с т и к а с в о й с т в
п р о с т ы х в е щ е с т в
Все галогены являются молекулярными веществами (состав молекул Г2), типичными неметаллами, диэлектриками. При обычных условиях фтор - почти бесцветный газ, хлор - газ желто-зеленого цвета, бром - темно-коричневая жидкость, а иод представляет собой кристаллическое вещество фиолетового цвета. При переходе от фтора к иоду последовательно увеличиваются температуры плавления и кипения галогенов (иод плавится только под повышенным давлением паров I2, в противном случае он из твердого состояния при нагревании непосредственно переходит в газообразное, т.е. сублимирует или возгоняется). Изменение агрегатного состояния, температур плавления и кипения в подгруппе галогенов является прямым результатом повышения энергии межмолекулярного взаимодействия. Поскольку молекулы Г2 неполярны, то единственным механизмом межмолекулярного взаимодействия в данном случае является дисперсионный.
Таблица 2
Некоторые характеристики галогенов
F2 Cl2 Br2 I2 At2
Ехим.св.Г-Г, кДж/моль 155 243 190 149 117
Нисп., кДж/моль 7 20 30 42
Тпл., оС -220 -101 -7 114 244
Ткип., оС -188 -34 59 186 309
Энергия такого взаимодействия определяется поляризуемостью (деформируемостью) молекул, что, в свою очередь, зависит от размеров их электронных облаков. Усиливающееся межмолекулярное притяжение в случае брома и иода приводит к объединению соответствующих молекул, что сопровождается образованием жидкой и твердой фаз. В хлоре и фторе это взаимодействие настолько невелико, что кинетической энергии молекул оказывается достаточно, чтобы его преодолеть. Соответственно, эти вещества в обычных условиях имеют газообразное состояние.
Природой межмолекулярного взаимодействия объясняется разная растворимость галогенов в воде и в органических растворителях. Молекулы органических веществ, как правило, малополярны, поэтому также склонны, главным образом, к дисперсионному взаимодействию. Это облегчает однородное распределение молекул галогенов в таких растворителях. Сильно полярные молекулы воды предрасположены к ориентационному взаимодействию (например, при гидратации ионов), а также образуют очень прочные водородные связи. Молекулы же галогенов не способны эффективно участвовать в такого рода взаимодействиях.
Растворимость галогенов в одном и том же растворителе, как правило, уменьшается при переходе к Br2 и I2, т.к. в этих случаях для растворения требуется разрушить относительно прочные межмолекулярные связи в галогенах.
Ну и, наконец, следует отметить, что фтор не растворяется в воде, а разлагает, окисляет ее :
2F2
+ H2O
![]() 2HF + OF2
(O2,
O3)
2HF + OF2
(O2,
O3)
Характеристику химических свойств следует начать с анализа реакционной способности галогенов. Самым активным среди них является фтор, что обусловлено низкой энергией связи в молекуле F2. Хлор и бром мало отличаются друг от друга по химической активности, а реакционная способность иода при обычных условиях занижена по причине образования кристаллической решетки: при низких температурах реакции с участием иода являются гетерогенными, и их скорость определяется площадью поверхности раздела взаимодействующих веществ. Высокая активность фтора проявляется в том, что он взаимодействует даже с такими устойчивыми, инертными веществами, как оксид кремния, благородные газы и т.п. :
SiO2
+ 2F2
![]() SiF4
+ O2
SiF4
+ O2
2Au
+ 3F2
![]() 2AuF3
2AuF3
Во всех этих реакциях фтор выступает в качестве окислителя. При этом атомы фтора понижают степень окисления от нуля до минус одного, чему способствует высокая энергия связи в получающихся фторидах (см. разд.4). Типичными окислителями в самых разнообразных реакциях являются и все остальные галогены. Однако, поскольку стабильность степени окисления минус один по подгруппе падает, окислительные свойства галогенов в ряду от фтора к иоду (астату) уменьшаются. Наглядным примером, иллюстрирующим закономерности в изменении химической активности, окислительной способности галогенов является их отношение к водороду. Фтор энергично взаимодействует с водородом даже в темноте при обычных температурах. Реакция протекает по цепному механизму и сопровождается взрывом. Хлор также со взрывом окисляет водород, но для инициирования этой реакции требуется или кратковременный нагрев, или воздействие ультрафиолетового излучения. Бром и иод реагируют с водородом только при постоянном нагревании (в последнем случае требуется более высокая температура). Причем, из-за низкой устойчивости иодоводорода, он в этих условиях заметно разлагается, поэтому реакция синтеза HI оказывается обратимой:
![]()
![]()
![]()
![]()
За исключением фтора все галогены обладают и восстановительными свойствами, которые повышаются при переходе от хлора к иоду и астату в соответствие с ростом устойчивости низших положительных степеней окисления. Наиболее типичной реакцией, в ходе которой галогены проявляют свои восстановительные свойства является их диспропорционирование при частичном взаимодействии с водой. Причем, реализация тех или иных положительных степеней окисления (наряду с минус один) строго коррелирует с изменением восстановительных свойств. Например, в случае хлора получается хлорноватистая кислота:
Cl2
+ H2O
![]() HCl + HOCl
HCl + HOCl
тогда, как при диспропорционировании иода основным продуктом окисления является иодноватая кислота:
I2
+ H2O
![]() HI + HIO3
HI + HIO3
Увеличить полноту протекания этих процессов можно в щелочной среде. В этом случае один из продуктов реакций (протоны) связываются в малодиссоциирующий электролит (воду), что приводит к смещению соответствующих равновесий:

Закономерности изменения как окислительных, так и восстановительных свойств в подгруппе галогенов четко проявляются в реакциях между ними - в качестве окислителя всегда выступает галоген с меньшим порядковым номером: а) в газовой фазе:
![]()
б) в водном растворе:

6.2 С р а в н е н и е с в о й с т в г а л о г е н и д о в

Таблица 2
Температуры плавления и кипения галогеноводородов
HF HCl HBr HI
Эффективный заряд
на атоме галогена -0.42 -0.17 -0.12 -0.05
Тпл , 0С -83 -114.2 -86.9 -50.8
Ткип, 0С 19.5 -85.1 -66.8 -35.4
Химические свойства галогеноводородов во многом определяются энергиями связей в них. Этот вопрос подробно обсуждался в разд.4. Последовательное уменьшение прочности связи HГ приводит к усилению кислотных свойств: если HF - кислота средней силы, то HI - самая сильная среди галогеноводородов. И это неудивительно. Чем крупней молекула НГ, чем меньше энергия связи в ней, тем легче она поляризуется диполями воды и, в конечном итоге, распадается с образованием гидратированных ионов:
![]()
![]()
Поскольку в галогеноводородах атомы галогенов находятся в минимальной степени окисления, то данные вещества могут проявлять только восстановительные свойства. Способность реализовать эти свойства определяется стабильностью степени окисления минус один (разд.4), а, следовательно, растет от фторо- к иодоводороду. Фтороводород является настолько слабым восстановителем, что может быть окислен только в процессе электролиза. Поскольку сам фтороводород обладает слабой электропроводностью, а ионные фториды - относи-тельно высокими температурами плавления, для этих целей используют смесь KF и HF (Тпл 700С). Для окисления хлороводорода уже могут быть использованы некоторые вещества, обладающие в кислой среде очень высокими окислительными свойствами (KMnO4, K2Cr2O7, MnO2, PbO2 и т.п.):
2KMnO4 + 10HCl 5Cl2 + 2MnCl2 + 2KCl + 8H2O.
В свою очередь бромо- и иодоводород могут быть окислены и менее сильными окислителями. В частности, они взаимодействуют с концентрированной серной кислотой, причем, если в реакции с бромоводородом основным продуктом восстановления окислителя является SO2, то HI способен восстановить серную кислоту до S и даже H2S:
2HBr
+ H2SO4
(конц.)
![]() Br2
+ SO2
+2H2O
Br2
+ SO2
+2H2O
8HI
+ H2SO4
(конц.)
![]() H2S
+ I2
+ 4H2O
H2S
+ I2
+ 4H2O
Среди свойств других ковалентных молекулярных галогенидов (РГ5, СГ4 и др.) следует отметить, что энергия связи в них меняется также, как и в галогеноводородах (самыми устойчивыми являются фториды). Их общим химическим свойством является склонность к гидролизу, которая облегчается при переходе к иодидам, что однозначно коррелирует с их низкой устойчивостью. При гидролизе таких соединений образуется смесь двух кислот:
PF5
+ 4H2O
![]() H3PO4
+ 5HF
H3PO4
+ 5HF
SiCl4
+ 3H2O
![]() ''H2SiO3''
+ 4HCl
''H2SiO3''
+ 4HCl
Поэтому их называют диангидридами или галогенангидридами. Например, PCl5 - хлорангидрид ортофосфорной кислоты.
Ионные галогениды - кристаллические вещества. Их температуры плавления определяются энергиями кристаллических решеток и максимальны для фторидов (см. разд.4). Поскольку большинство ионных галогенидов (за исключением солей серебра, свинца, таллия (I) и некоторых других элементов) хорошо растворимы в воде, то реакции с их участием, как правило, выполняют в водных растворах. В этих условиях галогенид-ионы могут проявить свои восстановительные свойства (наиболее сильно они выражены у иона I-):
K2Cr2O7 + 14HBr + 6KI 3I2 + 2CrBr3 + 8KBr + 7H2O

6.3 С р а в н и т е л ь н а я х а р а к т е р и с т и к а
о д н о т и п н ы х к и с л о р о д с о д е р ж а щ и х к и с л о т
и и х с о л е й
В положительных степенях окисления галогены образуют достаточно много и кислот, и солей. Их характеристика предусматривает поиск и объяснение общих черт, а также анализ закономерностей различия важнейших свойств. Некоторые замечания по этим вопросам можно сделать уже сейчас, до более подробного разговора о соединениях, образуемых галогенами в той или иной конкретной степени окисления.
Во-первых, все положительные степени окисления для галогенов, в общем-то, мало характерны (хотя устойчивость их, конечно, разная). Поэтому их главным окислительно-восстановительным свойством, а в некоторых случаях единственным, является способность выступить в качестве окислителя (т.е. стремление понизить степень окисления атома галогена).
Второе, их получение, как правило, достаточно сложный процесс. В случае соединений хлора это, в основном, реакции диспропорционирования. Соответствующие соединения других галогенов могут быть получены, кроме того, с использованием таких сильных окислителей, как хлор (хлорная вода), HNO3(конц.).
В-третьих, устойчивость соединений одного элемента, как правило, растет с увеличением степени окисления атома галогена (за счет более эффективного -связывания). Устойчивость же однотипных соединений, т.е. таких, в которых атомы галогенов имеют одну и ту же степень окисления, как правило, повышается при переходе от соединений хлора к соединениям иода (астата). Это предопределяется увеличением кратности связи ГО за счет увеличения разности электроотрицательностей атомов галогена и кислорода. В то же время, следует иметь в виду, что в реализации этих тенденций имеются некоторые исключения, приводящие к дестабилизации высшей положительной степени окисления (+7) у брома и, особенно, у астата.
И, наконец, в заключение отметим, что кислородсодержащие кислоты всегда менее устойчивы, чем соответствующие им соли. Это обусловлено высоким поляризующим действием протона на сложный анион, что приводит к понижению энергии связей в нем.
а) степень окисления +I. Энергия связей в анионах ГО- относительно невелика, и под влиянием протонов они легко разрушаются. Поэтому хлорноватистая, бромноватистая и иодноватистая кислоты в свободном виде не выделены, а существуют только в очень разбавленных растворах. Поскольку степень окисления “центрального” атома в НГО мала (+1), то кислотный характер у данных гидроксидов выражен очень плохо:
HOCl
![]() H+
+ ClO-
H+
+ ClO-
причем, т.к. поляризующее действие атомов Г+1 по подгруппе уменьшается (из-за увеличения радиуса) , то ослабевают и кислотные свойства. В итоге HIO оказывается уже амфотерным электролитом:
![]()
Несмотря на то, что соли более устойчивы (например гипохлорит кальция Ca(OCl)2 в смеси с хлоридом кальция CaCl2 составляют основу хлорной извести), как кислоты, так и их соли являются энергичными окислителями:
3KClO
+ 2K3[Cr(OH)6]
![]() 3KCl
+ 2K2CrO4
+ 2KOH + 5H2O
3KCl
+ 2K2CrO4
+ 2KOH + 5H2O
Причем окислительные свойства в ряду ClO- - BrO- - IO- уменьшаются. Более того, в связи с постепенной стабилизацией по подгруппе степени окисления +5 (см. разд.6.3), усиливаются восстановительные свойства данных анионов:
NaIO
+H2O2
![]() NaIO3
+ 2H2O.
NaIO3
+ 2H2O.
В отсутствие и восстановителей, и окислителей низкая устойчивость анионов ГО- приводит к их диспропорционированию:
3ГО-
![]() 2Г-
+ ГО3-
2Г-
+ ГО3-
(в случае гипоиодита преобладает процесс
3IО-
+ 2H2O
![]() 2I2
+ IО3-
+ 2OH-
).
2I2
+ IО3-
+ 2OH-
).
б) степень окисления +III. В этом случае характер изменения свойств кислот НГО2 и их солей во многом повторяет особенности соединений в степени окисления +1. Однако, встречаются они реже из-за высокой склонности к диспропорционированию:
3ГО2-
![]() Г-
+ 2ГО3-.
Г-
+ 2ГО3-.
в) степень окисления +V. Энергия связи в анионах ГО3- выше, чем в ГО- и в ГО2-. Поэтому кислоты типа НГО3 и соответствующие им соли (хлораты, броматы, иодаты) более устойчивы, чем аналогичные соединения галогенов в степенях окисления +1 и +3. В связи с этим уменьшаются окислительные свойства соединений галогенов +5. В то же время по подгруппе устойчивость однотипных соединений также повышается. Например, HClO3 может быть получен только в растворах с концентрацией до 40%, HBrO3 - до50%, тогда как HIO3 выделен в свободном виде. Если же еще принять во внимание, что от хлора к иоду (астату) уменьшаются все низшие потенциалы ионизации (от I1 до I5), то степень окисления +5 постепенно стабилизируется, а поэтому окислительные свойства и НГО3 и, скажем, КГО3 уменьшаются в подгруппе сверху вниз. Именно поэтому в приведенном ниже уравнении окислителем является бертолетова соль, а не иодноватая кислота (т.е. реакция идет слева направо, а не наоборот):
![]()
Наряду с окислительными свойствами, у соединений галогенов +5 могут наблюдаться и восстановительные свойства. В соответствие со стабилизацией высшей (+7) степени окисления в подгруппе галогенов восстановительные свойства несколько лучше выражены у соединений I (+5), чем у Cl (+5). В то же время высшая степень окисления неизвестна для астата и очень нехарактерна для брома (см. разд.5), а поэтому соединения At(+5) не могут быть окислены, а броматы проявляют восстановительные свойства только в сильно щелочной среде в реакциях с суперокислителями, типа F2:
![]()
Сила кислот в ряду HClO3 - HBrO3 - HIO3 уменьшается, причем Кд хлорноватой и бромноватой кислот близки (обе являются довольно сильными). Это обусловлено тем, что из-за 3d-сжатия радиусы атомов (и ионов Cl+V и Br+V) мало отличаются, а, следовательно, по поляризующему действию ион Br+5 лишь немного уступает Cl+V.
г) степень окисления +VII. Кислоты и, тем более, соли, образуемые галогенами в данной степени окисления более устойчивы, чем аналогичные соединения в других положительных степенях окисления. Так, например, в свободном виде существуют не только иодная кислота HIO42H2O (H5IO6), но и хлорная (HClO4). Но, в то же время, соединения астата (+7) не известны, а бромат-ион BrO4- крайне нестабилен и является очень сильным окислителем (особенно в кислой среде):
![]()
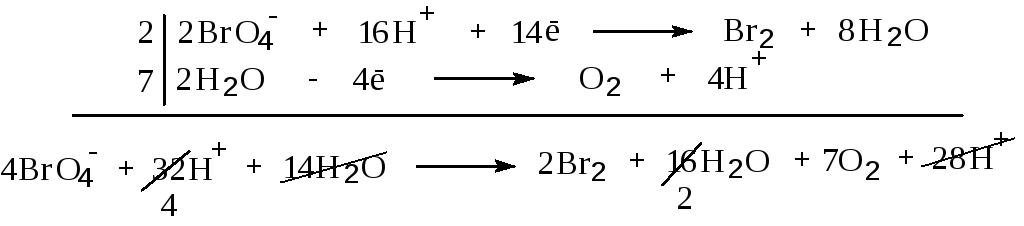
Это объясняется, с одной стороны, аномалиями в значениях высших потенциалов ионизации, а, с другой, - большими энергетическими затратами на вовлечение валентных s-орбиталей в атомах Br и At в sp3-гибридизацию (см. разд.5).
ПРИЛОЖЕНИЕ
Таблица 1

Таблица 2
Потенциалы ионизации атомов галогенов
I1 I2 I3 I4 I5 I6 I7
F 17.4 35.0 62.7 87.1 114.2 157.1 185.1
Cl 13.0 23.8 39.9 53.5 67.8 96.7 114.3
Br 11.8 21.6 35.9 47.3 59.7 88.6 103.0
I 10.5 19.1 31.4 41.7 52.1 76.8 90.2
At 9.2 Определены с низкой точностью.
1 Характер связи в нем сохранится ионным только при условии низкого поляризующего действия катиона (К+). В противном случае будет усиливаться доля ковалентного типа взаимодействия (в присутствии Н+ получаем ковалентные молекулярные галогениды).
2 Во фтороводороде кроме прочной внутримолекулярной ковалентной связи имеется довольно сильное межмолекулярное взаимодействие по типу "водородная связь".В определённом смысле оно носит донорно-акцепторный характер.
1 Способ установления водородных связей имеет определенное сходство с ковалентным донорно-акцепторным механизмом. Именно заметное участие атомных орбиталей (в данном случае атома водорода одной молекулы HF и атома фтора другой) и предопределяет высокую энергию этого взаимодействия: зачастую она на порядок превышает силы ван-дер-ваальса и составляет до 40% от энергии обычной ковалентной внутримолекулярной связи. Водородная связь может быть и внутримолекулярной, как, например, в аминокислотах, белках.
