
министерство общего и профессионального
образования Российской Федерации
Ростовский ордена трудового красного знамени
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
для студентов I-го курса дневного отделения
биолого-почвенного факультета
О Б Щ А Я Х А Р А К Т Е Р И С Т И К А
Г А Л О Г Е Н О В
г. Ростов на Дону
2002 г.
Бикяшев Э.А., Лисневская И.В.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
для студентов I-го курса дневного отделения
биолого-почвенного факультета
О Б Щ А Я Х А Р А К Т Е Р И С Т И К А
Г А Л О Г Е Н О В
Печатается по решению кафедры общей и неорганической
химии Ростовского ордена Трудового Красного Знамени госу-
дарственного университета.
Протокол N 2 от 18 февраля 2002г.
Рецензент – доктор хим.наук, е.Трубников И.Л.
Ответственный редактор - д-р.хим.наук, проф.Лупейко Т.Г.
С О Д Е Р Ж А Н И Е
1 Положение элементов в периодической системе..............................4
2 Электронное строение атомов, валентные возможности,
степени окисления ..................................................................................5
3 Изменение радиусов атомов ..............................................................6
4 Изменение устойчивости отрицательной степени окисления ..........7
5 Изменеие устойчивости положительных степеней окисления .......10
6 Сравнительная характеристика однотипных содинений
галогенов ..........................................................................................13
6.1 Характеристика свойств простых веществ ....................................13
6.2 Характеристика свойств галогенидов ............................................16
6.3 Характеристика свойств однотипных кислородсодержащих
кислот и их солей ........................................ ....................................19
Приложение .....................................................................................22
1 Положение элементов
В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
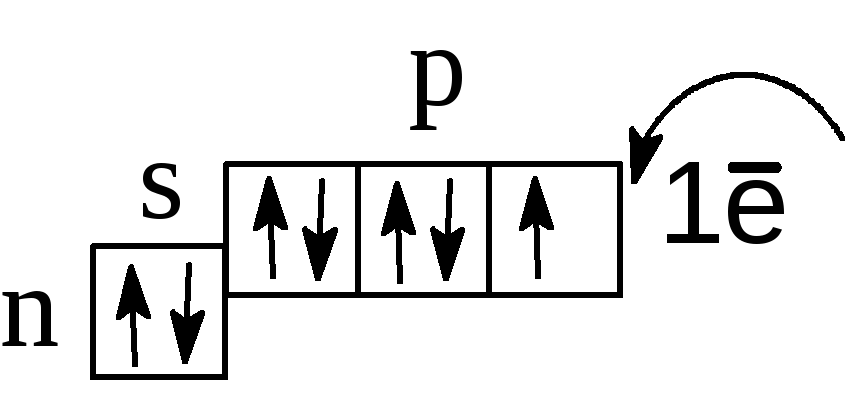
Эти свойства галогенов, казалось бы, очень сильно отличают их от элементов побочной подгруппы, в которую входят типичные металлы. Однако в высшей, групповой (+7) степени окисления элементы обеих подгрупп нередко образуют сходные по свойствам однотипные соединения. С одной стороны, это обусловлено довольно высоким, а в случае Cl+7 и Mn+7 очень высоким поляризующим действием атомов соответствующих элементов, что, в свою очередь, предопределяет ковалентный характер связи, кислотные свойства оксидов и гидроксидов. С другой стороны, у марганца, так, как и у галогенов, высшая степень окисления не стабильна, что влечет за собой сильные окислительные свойства соответствующих соединений. Например:
Cl2O7 и Mn2O7 - неустойчивые вещества, взрывоопасные жидкости; кислотные оксиды; сильные окислители.
HClO4 и HMnO4 - очень сильные кислоты; малоустойчивые соединения: HMnO4 существует только в водных растворах, HClO4 выделена в свободном виде, но способна к разложению со взрывом. Сами кислоты и их соли являются сильными окислителями (ClO4- - ион в разбавленных водных растворах достаточно стабилен, а поэтому окислительные свойства проявляет плохо).
