
- •Строение и функции днк. Авторепродукция днк. Биологическое значение, генетический код.Кодирование и реализация информации в клетке. Кодовая система днк и белка.
- •2. Роль рнк и днк в передаче наследственной информации. Основные этапы: транскрипция, процессинг, трансляция.
- •3. Количественная и качественная специфика проявления генов в признаки: пенетрантность, экспрессивность, плейотропность, генокопии.
- •4. Классификация генов: гены структурного синтеза рнк, регуляторы. Свойства генов: дискретность, стабильность, лабильность, специфичность, плейотропия.
- •5.Тонкая структура генов. Особенности про- и эукариот. Понятие о транскриптоне.
- •6.Принципы регуляции генной активности на примере прокариот( модель оперона) и эукариот.
- •7. Генотип, геном, фенотип. Фенотип как результат реализации наследственной информации в специфических условиях среды.
- •8. Генная инженерия. Биотехнология. Задачи, методы. Достижения, перспективы.
5.Тонкая структура генов. Особенности про- и эукариот. Понятие о транскриптоне.
Раньше считалось, что гены представляют собой часть хромосомы и являются неделимой единицей, обладающей рядом свойств: способностью определять признаки организма; способностью к рекомбинации, т. е. перемещению из одной гомологичной хромосомы в другую при кроссинго-вере; способностью мутировать, давая новые аллельные гены.
В дальнейшем оказалось, что ген представляет собой сложную систему, в которой указанные особенности не всегда бывают нераздельными.
Первые представления о, сложной структуре гена возникли еще в 20-х годах текущего столетия. Советские генетики А. С. Серебровский и Н. П. Дубинин выдвинули предположение, что ген состоит из отдельных «ступенек». В настоящее время это блестяще подтвердилось новыми исследованиями. Установлено, что ген представляет собой часть молекулы ДНК и состоит из сотен пар нуклеотидов. Ген как функциональную единицу американский генетик С. Бензер предложил назвать цистроном. Именно цистрон определяет последовательность аминокислот в каждом специфическом белке.
Цистрон в свою очередь подразделяется на предельно малые в линей
ном измерении единицы - р е к о н ы, способные к рекомбинации при
кроссинговере.
Выделяют, кроме того, понятие мутон- наименьшую часть гена, способную к изменению (мутированию).
Размеры рекона и мутона могут равняться одной или нескольким парам нуклеотидов, цистрона - сотням и тысячам нуклеотидов.
Оказалось, что разные функции гена связаны с отрезками цепи ДНК различной величины. Ген оказался сложной структурой, внутри которой могут осуществляться процессы мутирования и рекомбинации.
Синтез молекул РНК начинается в определенном месте матрицы, называемом промотором и заканчивается в определенном месте, называемом терминатором. Участок ДНК, ограниченный промотором и терминатором, представляет собой единицу транскрипции — транскриптон. В пределах транскриптона копируется только одна цепь, которую называют значащей или матричной. У эукариот в состав транскриптона входит один ген. Транскриптон прокариот содержит несколько генов, его чаще называют оперон. Транскрипционный цикл включает несколько стадий: связывание транскриптазы с матричной цепью, инициацию цепи РНК, элонгацию, терминацию и посттранскрипционный процессинг. Процессинг может включать кэпирование 5'-конца, метилирование гуанидина, полиаденилирование 3'-конца, сплайсинг. При рассмотрении принципов транскрипции следует различать первичную транскрипцию (синтез на геномной матрице) и вторичную транскрипцию (синтез на вновь синтезированной матрице).
6.Принципы регуляции генной активности на примере прокариот( модель оперона) и эукариот.
В настоящее время известно о существовании различных систем регуляции активности (экспрессии) генов, которые функционируют на том или ином этапе реализации генетической информации. Первая модель генетического контроля биосинтеза белков, положившая начало современной теории генетической регуляции, была предложена французскими учеными Ф.Жакобом и Ж. Моно (F.Jacob, J.Monod, 1961) на основе экспериментов, проведенных с клетками бактерий. Эти авторы ввели понятие об опероне как единице координированной экспрессии генов (единице генетической регуляции).
Концепция оперона была разработана Ф.Жакобом и Ж.Моно на примере регуляции синтеза ферментов, необходимых для использования углевода лактозы клетками кишечной палочки (Esche-richia coli). Как известно, лактоза представляет собой дисахарид, молекула которого является соединением, состоящим из глюкозы и галактозы. Согласно предложенной модели, в рамках оперона происходит регуляция активности структурных генов на этапе транскрипции генетической информации.
Как видно из рис. 1.22, в составе лактозного оперона E.coli находятся структурные гены, обозначенные символами z, у, а, которые кодируют синтез трех различных белков-ферментов, участвующих в утилизации лактозы. Так, фермент β-галактозидаза
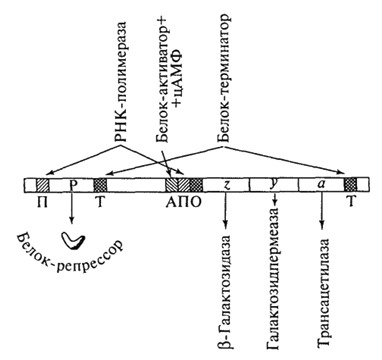
Рис. 1.22. Лактозный оперон Е. coli: П промотор; Р ген-регулятор; Т терминатор; А участок прикрепления белка-активатора; О оператор; i,y, a структурные гены
расщепляет молекулу лактозы с образованием молекул двух моносахаридов (глюкозы и галактозы), галактозидпермеаза обеспечивает активный транспорт лактозы в бактериальную клетку из окружающей среды, тогда как роль третьего фермента (трансацетилазы, или Л-белка) точно не установлена.
Помимо указанных генов в структуре оперона выделяются акцепторные участки (специфические нуклеотидные последовательности ДНК), которые необходимы для прикрепления белка-активатора (участок активатора), РНК-полимеразы (промотор) и белка-регулятора, названного репрессором, (оператор), а также терминатор, обеспечивающий прекращение синтеза полигенной мРНК (см. рис. 1.22). Следует, однако, заметить, что в рамках современной теории генетической регуляции участок активатора и оператор принято рассматривать в качестве составных частей промоторной области, структурно-функциональные особенности которой обсуждались выше (см. подразд. 1.5).
Функционирование лактозного оперона E.coli основано на принципе, который Ф.Жакоб и Ж. Моно назвали негативной индукцией, поскольку в этом случае регулирующий белок (репрессор) проявляет отрицательный эффект, блокируя транскрипцию структурных генов z, У, а, тогда как сама лактоза выступает в качестве индуктора этого процесса, что сопровождается синтезом соответствующих ферментов (рис. 1.23).
При отсутствии лактозы в бактериальной клетке синтезируется активный белок-репрессор под контролем гена-регулятора, который принципиально не отличается от обычного структурного гена, обладая собственным промотором и терминатором. Активный реп-рессор, представляющий собой сложный аллостерический тетра-мерный белок, соединяется с нуклеотидной последовательностью оператора, блокируя инициацию транскрипции в стартовой точке гена, которую должна осуществлять РНК-полимераза,

Рис. 1.23. Репрессия (а) и индукция (б) в лактозном опероне Е. coli
предварительно связавшаяся с узнаваемой ею нуклеотидной последовательностью промоторной области (см. также подразд. 1.5). Принципиальный смысл механизма репрессии этого оперона схематично изображен в верхней части рис. 1.23.
Появление лактозы в среде обитания бактерий может сопровождаться проникновением небольших ее количеств в бактериальную клетку. При этом лактоза начинает выступать в роли эффектора, присоединяясь к определенному участку молекулы бел-ка-репрессора, что приводит к изменению конфигурации этой молекулы и ее инактивации (аллостерический эффект). Поскольку неактивный репрессор теряет способность соединяться с оператором, то становятся возможными инициация транскрипции и последующий непрерывный синтез полигенной молекулы мРНК, прекращающийся в области терминатора, а также синтез трех указанных ферментов на этапе трансляции генетической информации (см. нижнюю часть рис. 1.23). Эти ферменты, в свою очередь, обеспечивают быстрое проникновение лактозы в клетку из окружающей среды и ее дальнейшее расщепление на глюкозу и галактозу. Процесс транскрипции вновь будет заблокирован непрерывно синтезируемым репрессором после расщепления всей лактозы, имеющейся в клетке, при ее отсутствии в окружающей среде.
Как видно из рассмотренного выше, работа лактозного оперона (как и других изученных бактериальных оперонов) осуществляется по принципу саморегуляции на основе обратной связи, согласно которому время синтеза и количество синтезируемого белка-фермента определяются его необходимостью для обеспечения того или иного метаболического процесса, связанного с жизнедеятельностью клетки.
Следует отметить, что в процессе дальнейшего изучения лактозного оперона и других оперонов бактерий были получены сведения о том, что помимо негативного (репрессорного) механизма регуляции транскрипции в этих оперонах действует также позитивный механизм, связанный с функциями различных белков, являющихся активаторами транскрипции. Так, в случае лактозного оперона
установлено существование такого белка, который, в свою очередь, активируется путем предварительного связывания с циклическим аденозинмонофосфатом (цАМФ). Указанный бел о к-активатор соединяется со специфическим участком в начале промоторной области (см. рис. 1.22), который содержит последовательность, узнаваемую РНК-полимеразой, и обеспечивает нормальное прикрепление и дальнейшее функционирование последней.
Было установлено также, что такой белок, активированный цАМФ, является фактором позитивной регуляции транскрипции не только лактозного оперона, но и нескольких других катаболизирующих оперонов Е. со//. Если в клетке имеется достаточное количество глюкозы либо другого легко усваиваемого моносахарида, то активируется работа соответствующего оперона, обеспечивающего утилизацию такого углевода. При этом значительно снижается концентрация цАМФ, что приводит к репрессии группы оперонов, включая лактозный, связанных с утилизацией дисахаридов. Если в клетке нет достаточного количества глюкозы и других моносахаридов, то концентрация синтезируемого цАМФ возрастает. В связи с этим при наличии лактозы становится возможной активация работы лактозного оперона с помощью белка-активатора, обеспечивающего нормальное функционирование РНК-полимеразы в этом опероне, т. е. бактерии начинают использовать менее выгодный, чем глюкоза, источник углерода. Имеются также экспериментальные данные, показывающие, что добавление цАМФ в питательную среду, в которой размножаются бактерии, снимает катаболитную репрессию лактозного и других подобных оперонов. Следовательно, у прокариот может иметь место согласованная регуляция функционирования разных оперонов на стадии инициации транскрипции.
Нужно, однако, иметь в виду, что регуляция активности генов прокариот на этапе транскрипции не ограничивается лишь стадией инициации этого процесса, но осуществляются также и во время его элонгации и терминации.
Что касается эукариот, включая человека, то внутриклеточная регуляция биосинтеза белков у этих организмов является гораздо более сложной и менее изученной, чем у бактерий и вирусов, что связано, в первую очередь, с особенностями организации их геномов.
Как было отмечено в подразд. 1.5, инициация транскрипции у эукариот тесно связана с наличием тех или иных специфических последовательностей в составе промоторной области отдельных генов, которые должны узнаваться соответствующей РНК-полимеразой. При этом для РНК-полимераз разных типов (I, II, III и др.) должны существовать отличающиеся друг от друга последовательности. Как и в случае прокариот, такие последовательности должны распознаваться соответствующими специфическими белками-активаторами (факторами транскрипции), с помощью
которых осуществляется правильное прикрепление и активация определенной РНК-полимеразы, что является обязательным условием для инициации транскрипции. Стадии элонгации и терминации транскрипции у эукариот также обеспечиваются участием белковых факторов, регулирующих эти процессы.
Как известно, к числу особенностей эукариот относится прерывистая (мозаичная) структура их генов и связанный с этим процессинг РНК. При рассмотрении структуры эукариотического гена в подразд. 1.4 уже упоминалась возможная роль интронов в регуляции процессинга мРНК и сплайсинга ее экзонных участков. В настоящее время имеются данные о том, что помимо обычного (типичного) сплайсинга в некоторых случаях возможно также появление его альтернативного варианта, связанного с изменением порядка соединяемых экзонных фрагментов. Так, например, если при типичном варианте сплайсинга мРНК, состоящей из 5 экзонных участков, происходит их соединение в последовательности 1 — 2 — 3 — 4 — 5, то при альтернативном сплайсинге возможны иные варианты (2 — 3—1—4 — 5, 3 — 4 —2—1 — 5 и др.). В результате на основе одной и той же нуклеотидной последовательности конкретного гена могут формироваться разные варианты белковых молекул, которые будут представлять собой структуры, состоящие из разных сочетаний одних и тех же аминокислотных блоков. Следовательно, в этом случае проявляется принцип достаточно экономного использования имеющейся генетической информации эукариотического организма в разные периоды его жизнедеятельности.
У эукариот наблюдается также групповая регуляция активности генов на этапе транскрипции, связанная с особенностями организации гетерохроматиновых и эухроматиновых участков их хромосом, которая будет более подробно обсуждаться в гл. 2.
В настоящее время известны механизмы регуляции активности генов, которые действуют и на этапе трансляции генетической информации в клетке. У бактерий имеется не менее трех белковых факторов, участвующих в регуляции инициации трансляции, которые обозначаются символами IF-l, IF-2, IF-3 (от англ, initiation factor — фактор инициации). При образовании инициирующего комплекса (см. рис. 1.19) фактор /F-3 связывается с 3ОS- субъединицей рибосомы, препятствуя преждевременному объединению малой и большой субъединиц. Фактор инициации IF-2 соединяется с инициирующей аминоацил-тРНК, несущей формилметионин, и при участии IF-1 обеспечивает ее правильное прикрепление к Р-участку малой субъединицы рибосомы, завершая формирование инициирующего комплекса. Инициация заканчивается объединением рибосомных субъединиц 30S и 50S (см. рис. 1.19), которое сопровождается освобождением всех трех факторов инициации, покидающих рибосому. У эукариот имеется другой набор
факторов инициации трансляции, механизм действия которых является менее изученным.
Стадии элонгации и терминации трансляции также регулируются соответствующими белковыми факторами как у прокариот, так и у эукариот. Как уже отмечалось в подразд. 1.5, завершение трансляции связано с вступлением в Л-участок рибосомы одного из терминирующих кодонов мРНК (УАА, УАГ, УГА). Эти кодоны узнаются соответствующими белковыми факторами терминации, которые обеспечивают разрушение связи между последней тРНК и мРНК в Р-участке рибосомы и освобождение синтезированного полипептида, а также диссоциацию рибосомных субъединиц.
Можно полагать, что регуляция экспрессии генов осуществляется и на этапе посттрансляционной модификации полипептидов, однако механизмы такой регуляции исследованы недостаточно.
Оценивая особенности генетической регуляции биосинтеза белков у эукариот, необходимо отметить, что в случае многоклеточных организмов, включая человека, ее механизмы являются исключительно сложными и имеют многоуровневый характер, не ограничиваясь лишь процессами, происходящими в рамках одной клетки.
Для млекопитающих и человека установлено существование большого числа факторов регуляции различных надклеточных уровней (тканеспецифические и органоспецифические белки-активаторы, факторы нервной и эндокринной систем и др.). В качестве одного из примеров можно рассмотреть участок тканеспецифического энхансера, расположенный в районе β-глобинового гена человека (см. рис. 1.16). Поскольку β-глобин является тканеспецифическим белком, то кодирующий его ген активно экспрессиру-ется лишь в клетках красного костного мозга и в их предшественниках. Предполагается, что этот процесс регулируется с помощью обсуждаемого энхансера, нуклеотидная последовательность которого связывает тканеспецифический белок-активатор, обеспечивающий эффективную экспрессию β-гена только в клетках указанной ткани.
Более детальное рассмотрение этих механизмов является задачей ряда других биологических дисциплин (биологии развития, биохимии и физиологии нервно-эндокринной системы и др.).
