
- •Глава 7 – “Движение в пористой среде” отражает четко границы приме-
- •Раздел 1. Физические свойства жидкости, газов
- •Глава 1. Основные физические свойства жидкости.
- •1.2. Понятие о жидкости
- •1.3. Плотность, удельный объем, удельный вес, сжимаемость, температурное расширение, поверхностное натяжение жидкости
- •1.4. Вязкость, закон вязкости трения
- •1.5. Приборы для измерения плотности и вязкости
- •Тест – тренинг - контроль 1-1
- •Раздел 2. Гидростатика.
- •Методические указания
- •Глава 2. Законы гидростатики и их практическое
- •2.2. Основное уравнение гидростатики
- •2.3. Гидростатическое давление, его свойства
- •2.4. Центр давления
- •2.5. Давление жидкости на плоскую стенку
- •2.6. Давление жидкости на криволинейные поверхности
- •2.7. Гидростатический парадокс
- •1.3. Давление в покоящейся жидкости
- •1.4. Сила статического давления жидкости на плоскую стенку
- •1.5. Сила статического давления жидкости на криволинейные стенки. Закон Архимеда
- •1.6. Относительный покой жидкости
- •1.6.1. Прямолинейное равноускоренное движение сосуда
- •2.8. Эпюры гидростатического давления
- •2.9. Закон Архимеда
- •2.10. Приборы для измерения давления жидкостей и газов.
- •2.11. Простые гидравлические машины и устройства
- •2.12. Принцип действия гидравлических машин
- •Тест – тренинг - контроль 2-1
- •Раздел 3. Гидродинамика.
- •Методические указания
- •Глава 3. Динамика жидких и газовых сред
- •3.4. Графическая иллюстрация уравнения Бернулли
- •3.5. Алгоритм решения задач по применению уравнения д.Бернулли
- •3.6. Измерение расхода и скорости жидкости
- •3.7. Расходомеры, применяемые в промышленности
- •3.8. Центробежный насос
- •3.9. Достоинства и недостатки ц.Н.
- •3.10. Насосная установка
- •Тест – тренинг - контроль 3-1
- •3.11. Гидравлические сопротивления
- •Методические указания
- •3.12. Число Рейнольдса, режим движения
- •3.13. Шероховатость стенок труб
- •3.14. График Никурадзе
- •3.15. Определение потерь напора в трубопроводах
- •3.16. Влияние различных факторов на коэффициент λ
- •3.17. Потери напора в трубах некруглого сечения
- •3.18. Местное сопротивление
- •3.20. Коэффициенты местных сопротивлений
- •3.21. Алгоритм решения задач по определению суммарных потерь напора
- •3.22. Сопротивление при обтекании тел
- •Тест – тренинг - контроль 3-2
- •Глава 4. Динамика движения жидкости в
- •Методические указания
- •4.1. Классификация трубопроводов
- •4.3. Основные задачи при расчете трубопроводов
- •7. Гидравлический расчёт сложных трубопроводов
- •4.4. Кавитация
- •4.5. Сифонные трубопроводы
- •4.7. Меры борьбы гидравлического удара
- •4.8. Полезное использование гидроудара в нгп
- •4.9. Расчет напорных нефтепроводов
- •Тест – тренинг - контроль 4 -1
- •Глава 5. Истечение жидкости из отверстий и насадок
- •Методические указания
- •5.1. Истечение жидкости из отверстий в тонкой стенке при постоянном давлении
- •8. Истечения жидкости через отверстия и насадки
- •5.2. Истечение жидкости через насадки
- •5.3. Гидравлические струи жидкости. Структура гидравлической струи. Дальность полета струй
- •5.4. Давление струи на твердую преграду
- •Тест – тренинг - контроль 5-1
- •Глава 6. Газодинамика.
- •Методические указания
- •6.1. Понятия: газовая динамика; закономерности течения газов (уравнение неразрывности, уравнение Бернулли); истечение газа из неограниченного объема; весовой расход
- •Тест – тренинг – контроль 6 – 1
- •Глава 7. Движение жидкости в пористой среде
- •Методические указания
- •7.1. Основные понятия и определения фильтрации
- •7.2. Основной закон фильтрации и границы его применения
- •7.3. Закон Дарси
- •7.4. Физический смысл к (коэффициента фильтрации)
- •7.5. Приток грунтовой воды к сооружениям
- •7.6. Простейшие случаи установившейся напорной фильтрации несжимаемой жидкости
- •Тест – тренинг - контроль 7-1
- •Раздел 4. Неньютоновские жидкости
- •Методические указания
- •Глава 8. Режимы движения вязкопластичной
- •8.2. Вязкопластичные жидкости и их свойства
- •Режимы движения вязкопластичной жидкости
- •8.4 Роль бурового раствора в б.Н.Г.С. Условия выноса разбуренной породы на поверхность
- •8.5 Турбобур
- •Раздел 5. Основы термодинамики
- •Глава 9. Основные газовые законы. Теплоемкость
- •Методическое указание
- •9.1. Основные определения и законы идеальных газов.
- •Закон Гей-Люссака
- •Закон Шарля
- •Уравнение состояния идеальных газов.
- •Закон Авогадро
- •Уравнение Менделеева
- •Тест - тренинг - контроль 9-1
- •4. Изотермический
- •9.2. Газовые смеси. Теплоемкость смеси
- •9.3. Понятие газовой смеси. Парциальное давление. Основные характеристики смеси
- •9.4. Теплоемкость: виды, истинная и средняя. Теплоемкость
- •Контрольные вопросы:
- •Тест – тренинг - контроль 9 -2
- •9.5. Внутренняя энергия. Энтальпия. Принцип эквивалентности Методические указания
- •Энтальпия, как функция температуры
- •Тест – тренинг - контроль 9-3
- •Глава 10. Термодинамические процессы изменения состояния
- •Методическое указание
- •10.1. Классификация термодинамических процессов.
- •3. Изотермический процесс.
- •4. Адиабатный процесс.
- •5. Политропный процесс
- •Тест – тренинг - контроль 10-1
- •10.2. Второе начало (закон) термодинамики
- •Математическая запись закона
- •Энтропия
- •Контрольные вопросы:
- •Глава 11. Теоретические циклы паросиловых и холодильных установок двигателей внутреннего сгорания
- •Методические указания
- •11.1 Простейшая схема п.С.У.
- •11.2. Цикл Ренкина. Пути повышения экономичности п.С.У.
- •11.3. Цикл компрессорной холодильной установки
- •11.4. Теоретические циклы д.В.С. Циклы поршневых двигателей внутреннего сгорания
- •4.) Цикл со смешанным подводом количества тепла (Цикл Тринклер)
- •11.5. Циклы газотурбинных установок. Цикл гту
- •Тест – тренинг - контроль 11-1
- •Тест – тренинг - контроль 11-2
- •Глава 12. Термодинамические процессы компрессорных машин
- •Методические указания
- •12.1. Классификация компрессоров
- •12.2. Основные процессы работы одноступенчатого поршневого компрессора
- •12.3. Основные характеристики работы поршневого компрессора
- •12.4. Двухступенчатый компрессор
- •12.5 Достоинства и недостатки компрессоров
- •Контрольные вопросы:
- •Тест – тренинг - контроль 12-1
- •Глава 13. Водяной пар. Свойства водяного пара. Дросселирование газов и паров.
- •Методические указания
- •13.1. Процесс парообразования. Виды пара:
- •Тест – тренинг - контроль № 13 – 1
- •13.2. Истечение газов, дроссель – эффект.
- •Методическое указание
- •Раздел 6. Теплообмен.
- •Глава 14. Законы теплообмена.
- •14.1. Виды теплообмена. Формы передачи тепла.
- •14. 2. Передача теплоты теплопроводностью через плоскую однослойную и многослойную стенки
- •14. 3. Основной закон конвективного теплообмена
- •14.4. Теплообмен излучением между твердыми телами
- •14. 5. Теплопередача через плоскую и криволинейную однослойную и многослойную стенки
- •14.6.Теплопередача при переменных температурах (расчет теплообменных аппаратов)
- •Контрольные вопросы:
- •Глава 15. Топливо, продукты сгорания,
- •15.1. Топливо. Продукты сгорания.
- •15.2. Понятие о котельной установке, котельном агрегате и
- •15.3. Основные параметры работы парового котельного агрегата
- •15.4. Основные теории массопередачи
- •15. 5. Понятия о равновесии между фазами
- •15.6. Основное уравнение массопередачи
- •15.7. Основные законы термодинамики равновесных систем
- •Раздел 7. Массообмен
- •Глава 16. Основные законы равновесных систем и
- •16.1. Основные теории массопередачисистемы
- •16. 2. Абсорбция и десорбция
- •1. Сущность процесса абсорбции и десорбции
- •2. Сущность процесса экстракции
- •3. Сущность процесса адсорбции
- •2. Характеристики адсорбентов
- •Контрольные вопросы:
- •Тест – тренинг - контроль 16 – 1
9.2. Газовые смеси. Теплоемкость смеси
Понятие газовой смеси. Свойства, применение, способы задания газовых
смесей. Парциальное давление и объём компонентов смеси. Основные характе-
ристики смеси. Закон Дальтона.
Понятие теплоёмкости, её виды. Связь между теплоемкостями. Зависимость
теплоёмкости от температуры. Понятие истинной и средней теплоёмкости.
Определение количества тепла. Теплоёмкость газовой смеси.
Методическое указание

В данном разделе выделены основные уравнения для определения массовой
и объемной доли, понятие теплоемкости и зависимость от температуры и
давления сведены в таблицу.
9.3. Понятие газовой смеси. Парциальное давление. Основные характеристики смеси
Рабочее тело, как правило, представляет собой смесь нескольких газов.
Если считать, что каждый компонент подчиняется уравнению состояния идеального
газа и компоненты химически не реагируют между собой, то согласно закону Дальтона,
давление смеси газов равно сумме парциальных давлений отдельных компонентов смеси.
pсм = p1+p2+…+pn = ∑pι (9.1)
Парциальным называется V компонента, входящего в состав смеси,
при t и р смеси.
Сумма парциальных объемов компонентов газовой смеси равна
полному объему смеси.
Смесь состоит из нескольких чистых веществ, химически не взаимодействующих между собой. Примерами смесей могут служить воздух, состоящий из азота, кислорода и других газов.
К газовым смесям относятся и продукты сгорания топлива. Чистые вещества, составляющие смесь, принято называть компонентами.
Одна из важнейших характеристик смеси - ее состав.
Состав смеси обычно определяют посредством нахождения массовой или мольной концентрации компонентов, входящих в смесь. Если смесь состоит из массы m1 кг первого компонента, массы m2 кг второго компонента, массы m3 кг третьего компонента и так далее, то массовой концентрацией ί – го компонента называется отношение массы данного компонента mί к массе всей смеси многокомпонентный термодинамической системы m
gί = m1/ m2 . (9.2)
Состав рабочей смеси газов определяется количеством каждой составляющей,
входящей в смесь. Состав смеси обычно задают массовыми и объемными долями.
Если смесь массой m состоит из n компонентов, то массовые доли отдельных
компонентов в смеси равны:
g1
=
![]() g2
=
g2
=
![]() gn
=
gn
=
![]()
Сумма масс отдельных компонентов газовой смеси равна массе всей смеси:
m1 + m2 + ….. + mn = m ― уравнение массового состава газовой
смеси
g1 + g2 + ….. + gn = 1 ― уравнение относительного массового
состава газовой смеси
∑ массовых долей отдельных компонентов газовой смеси = 1.
Если смесь, состоящая из n компонентов имеет V, то объем доли
компонентов в смеси определяется:
r1
=
![]() ;
r2
=
;
r2
=
![]() ;
… rn
=
;
… rn
=
![]() .
.
V1, V2, …. Vn ― парциальные объемы компонентов, входящих в состав смеси.
V1 + V2 + …. + Vn = V ― уравнение объемного состава смеси
r1 + r2 + … + rn = 1 ― уравнение относительного объема состава
Между массовыми и объемными долями существует следующая зависимость:
τi
=
![]() (9.3)
(9.3)
τi ― объемная доля компонента;
gi ― объемная доля компонента;
Ri ― газовая постоянная компонента;
R ― газовая постоянная компонента.
Формула для определения газовой постоянной смеси:
R
=
![]() ;
R
=
;
R
=
![]() ;
(9.4)
;
(9.4)
или R
= g1R1
+ g2R2
+ g3R3
=
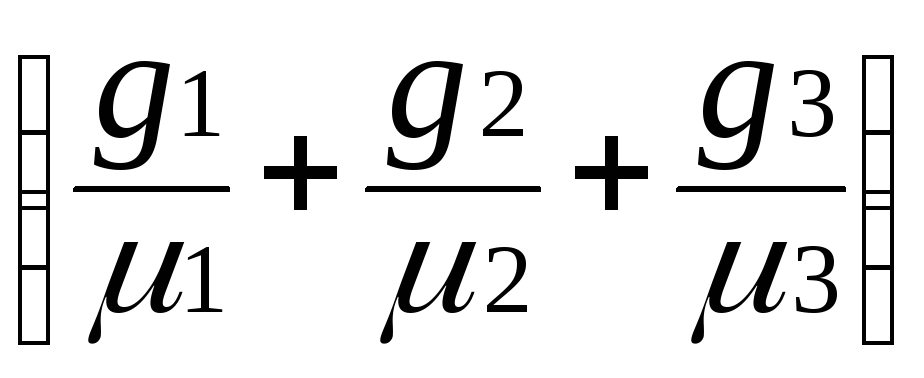 ∙
Ro.
(9.5)
∙
Ro.
(9.5)
μ =
![]() ― кажущаяся молекулярная масса.
― кажущаяся молекулярная масса.
Закон Дальтона
Закон Дальтона: давление смеси газов равно сумме парциальных давлений
отдельных компонентов.
р = р1 + р2 + ….. + рn (9.6)
р1, р2, рn ― парциальное давление.
Таблица 9.2.
Способы задания газовой смеси.
|
Задание состава смеси |
Перевод из одного состава в другой
|
Плотность и удельный объём смеси |
Кажущаяся молекулярная масса смеси
|
Газовая постоянная смеси |
Парциальное давление
|
|
Массовыми долями |
gi / mi ri = ——— n ∑gi/mi 1 |
n ύсм=∑ gi/pi 1
n pсм=1/∑ gi/pi 1 |
n μсм=1/∑ giRi 1 |
n Rсм=∑ giRi 1 |
Ri pi=gi—— pсм Rсм |
|
Объёмными долями |
n gi=ri/μi/∑riμi 1 |
n pсм=∑ripi 1
n ύсм=1/∑ ripi 1 |
n μсм=∑ riμi 1 |
8314 Rсм=——— n ∑riμi 1 |
pi= ri pсм |
