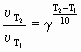5.2.2. Влияние температуры на скорость химической реакции
Изменение температуры оказывает резкое влияние на константу скорости, а следовательно, и на скорость химической реакции. В подавляющем большинстве случаев скорость химической реакции с нагреванием возрастает.
В 1879 г. голландский исследователь Г. Вант-Гофф обнаружил, что при повышении температуры на каждые 10 градусов скорость химической реакции возрастает, в среднем, в 2-4 раза (правило Вант-Гоффа):
|
|
(5.9) |
где
![]() -
скорость реакции при температуре T1
(начальная температура системы);
-
скорость реакции при температуре T1
(начальная температура системы);
![]() -
скорость реакции при температуре T2
(конечная температура системы);
-
скорость реакции при температуре T2
(конечная температура системы);
- температурный коэффициент реакции. Это число, показывающее, во сколько раз возрастает скорость данной реакции при повышении температуры на 10 градусов, т.е.
![]() ,
,
где kT - константа скорости реакции при температуре Т;
kT+10 - константа скорости реакции при температуре (Т+10);
Если концентрации реагентов равны 1 моль/л, то
![]()
Влияние температуры на скорость реакции тем значительнее, чем больше значение . Так, если равен трем, то при увеличении температуры на 100 скорость реакции возрастет в 310 раз, т.е. приблизительно в 59 тыс. раз. Следует иметь в виду, что правило Вант-Гоффа позволяет лишь примерно оценить влияние температуры на скорость реакции. Оно применимо для реакций, энергия активации которых находится в пределах: 80 < Ea < 170 кДж. Чем больше Еa, тем большую величину имеет . Графическая зависимость скорости реакции от температуры показана на рис. 5.4.
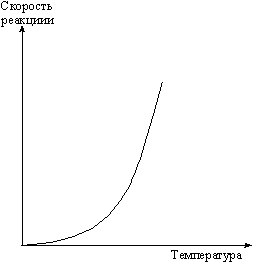
Рис. 5. 4. Зависимость скорости реакции от температуры.
В чем причина такого эффективного влияния? С увеличением температуры возрастает кинетическая энергия частиц, особенно в газовой фазе. Это приводит к увеличению числа соударений частиц, которое можно рассчитать на основе кинетической теории газов. Если при температуре Т1 число соударений равно Z1, а при температуре Т2 - равно Z2, то:
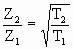
При Т1 = 273 К и Т2 = 373К:
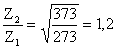
т.е. число соударений с повышением температуры возрастает незначительно (на 20%).
Несоответствие теоретически ожидаемой и действительной скорости привело к выводу (шведский химик С. Аррениус, 1889 г.), что не каждое соударение частиц эффективно и химическое взаимодействие имеет место, только если сталкивающиеся частицы обладают определенным избытком энергии по сравнению со средней энергией данных частиц.
Минимальную энергию, необходимую для того, чтобы произошло химическое взаимодействие, называют энергией активации (Еа).
Частицы, обладающие таким и большим запасом энергии, называют активными. Например, для зажигания спички ее предварительно нагревают посредством трения, а для зажигания смеси бензина с воздухом в автомобильном двигателе используется энергия искры. Активные частицы могут образовать при столкновении промежуточную неустойчивую группировку, находящуюся в состоянии перераспределения связей, называемую активированный комплекс, при дальнейшем превращении которого образуются продукты реакции (теория активации Аррениуса).
Энергию активации можно рассматривать как некую пороговую энергию, которую должны приобрести молекулы реагентов, чтобы преодолеть определенный энергетический барьер. Таким образом, Еа равна разности между средней энергией реагирующих частиц и энергией активированного комплекса. Еа определяется природой реагентов. Значение Еа колеблется в пределах от 0 до 400 кДж. Если значение Еа превышает 150 кДж, то такие реакции при температурах, близких к стандартной, не протекают. Влияние температуры на скорость реакции тем сильнее, чем больше величина Еа. Реакции с высокими Еа при низких температурах протекают с малыми скоростями, однако, влияние температуры на скорость таких реакций более значительно. Схема, приведенная на рис 5.5, поясняет эти представления.
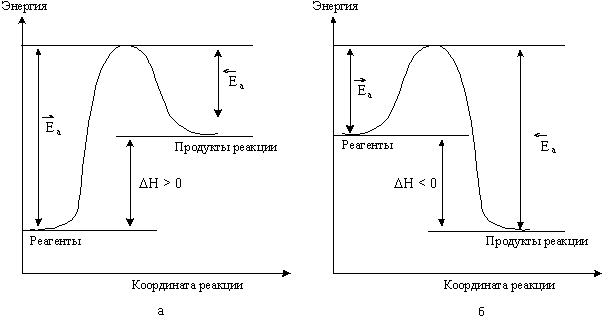
Рис.
5. 5. Изменение энергии реагирующей
системы: а - эндотермическая реакция; б
- экзотермическая реакция. На схеме:
![]() и
и
![]() -
энергии активации прямой и обратной
реакций. В соответствии с законом
сохранения энергии разность между ними
равна тепловому эффекту реакции.
-
энергии активации прямой и обратной
реакций. В соответствии с законом
сохранения энергии разность между ними
равна тепловому эффекту реакции.
В обычных условиях только часть молекул реагентов обладает достаточной энергией, чтобы преодолеть энергетический барьер, т.к. молекулы одного и того же вещества при одинаковых условиях движутся с различной скоростью и обладают, поэтому различным запасом кинетической энергии. Иными словами, молекулы имеют распределение по скоростям и энергиям (закон Д.К. Максвелла-Больцмана, 1860 г.). Ему отвечает кривая, представленная на рис.5.6.
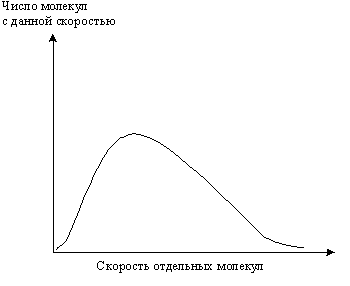
Рис. 5. 6. Распределение молекул по скоростям при данной температуре.
Изотерма, круто поднявшись и пройдя через максимум (он отвечает наиболее вероятной скорости при данной температуре), опускается, асимптотически приближаясь к оси абсцисс. Энергия молекул определяется скоростью их движения. Поэтому их энергетический “спектр” будет подобен рассмотренному. Схематически он показан на рис.5.7.
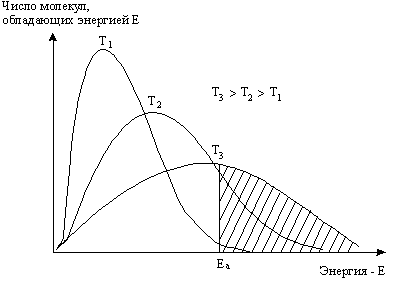
Рис. 5. 7. Распределение молекул по энергиям при различных температурах.
Площадь под каждой кривой равна общему числу частиц. Реакционноспособными будут лишь те частицы, энергия которых отвечает некоторому порогу Еа. Соответствующая величине Еа энергия (по сравнению со средней энергией молекул) и есть энергия активации. Число реакционноспособных частиц графически выражается заштрихованной площадью. Отношение ее ко всей площади под каждой изотермой равно доле активных молекул. При повышении температуры происходит смещение распределения молекул по скоростям в сторону больших энергий, и при этом существенно увеличивается доля молекул с высокими энергиями (равными или большими, чем Еа, способных вступать в реакцию). Количественная закономерность, описывающая влияние температуры на константу скорости одностадийной реакции, выражается уравнением С. Аррениуса (1889 г.):
|
|
(5.10) |
где k - константа скорости реакции;
A - предэкспоненциальный множитель - постоянная величина, определяемая природой реагентов;
Eа - энергия активации, Дж/моль;
R - универсальная газовая постоянная;
e = 2,71828 - основание натуральных логарифмов;
T – температура, К;
A = P·Z, где Р - стерический (пространственный) фактор, учитывающий влияние пространственной ориентации молекул на скорость реакции. Р изменяется от 10-9 до 1 (величина Р мала для реакций между сложными органическими молекулами);
Z - количество соударений между частицами.
Если
принять во внимание, что е-x
= 1/еx,
то нетрудно понять, что выражение (5.10)
имеет смысл доли молекул, обладающих
достаточной энергией Еa,
чтобы вступить в реакцию. Чем больше
величина Еa,
тем меньше скорость реакции. Если же
энергия активации остается постоянной,
а температура повышается, то указанная
доля молекул, определяемая выражением
![]() ,
становится больше. Экспериментально
установлено, что реакции, для которых
значение энергии активации превышает
150 кДж/моль, при комнатных температурах
не протекают, даже если G
< 0 (так называемое “кинетическое
препятствие”). В то же время ионные
реакции обмена в растворах электролитов
протекают с высокими скоростями, т.к.
Еa
подобных реакций близка к нулю. В
химической кинетике часто используют
уравнение Аррениуса в логарифмической
форме:
,
становится больше. Экспериментально
установлено, что реакции, для которых
значение энергии активации превышает
150 кДж/моль, при комнатных температурах
не протекают, даже если G
< 0 (так называемое “кинетическое
препятствие”). В то же время ионные
реакции обмена в растворах электролитов
протекают с высокими скоростями, т.к.
Еa
подобных реакций близка к нулю. В
химической кинетике часто используют
уравнение Аррениуса в логарифмической
форме:
|
|
(5.11) |
Из уравнения видно, что зависимость k от T, построенная в координатах: ln k - 1/T, имеет линейный характер (рис.5.8). Эта зависимость позволяет графически определить значение Еa и А, которые являются важнейшими характеристиками каждой реакции.
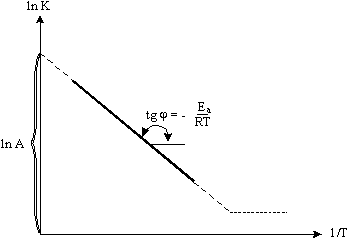
Рис. 5. 8. Зависимость ln k от 1/T.