
5.2.3. Влияние катализатора на скорость химической реакции. Понятие о катализе
Катализатор - это вещество, которое или резко меняет скорость реакции, или вызывает последнюю, если она не идет, но принципиально возможна, т.е. G < 0. Сам катализатор (Kat) принимает участие в промежуточных процессах, но регенерируется в конце реакции, т.е. стехиометрически в реакции не участвует. В большинстве случаев катализаторы увеличивают скорость реакции. Например, самопроизвольное разложение пероксида водорода:
2H2O2 = 2H2O + O2
происходит медленно, но добавление незначительного количества диоксида марганца (MnO2) ускоряет реакцию почти до взрыва. Смесь алюминия и паров иода при комнатных температурах не обнаруживает заметных признаков взаимодействия, но достаточно капли воды, чтобы вызвать бурную реакцию: fG(AlI3) = -304,55 кДж/моль.
Существуют катализаторы, оказывающие противоположный эффект, т.е. замедляющие скорость реакций - ингибиторы. Они замедляют нежелательные процессы, например, коррозию. Катализаторы отличаются избирательностью (селективностью) действия. Например, в зависимости от вида катализатора и условий проведения реакции из этилового спирта можно получить до 40 видов различных продуктов. Огромное практическое значение катализаторов обусловлено возможностью быстро, без затраты энергии получать в больших количествах самые разнообразные вещества. Химические производства, использующие катализаторы, перерабатывают самое дешевое сырье, которое дает природа: природные газы, воздух, руды, нефть, уголь и др., преобразуя их в синтетический каучук и другие полимеры, высококачественные бензины, аммиак, азотную и серную кислоты, минеральные удобрения, органические растворители, красители и многие другие ценные продукты. Явление селективного ускорения химических реакций под действием катализаторов называется катализом (от греч. katalysis -возбуждение). Различают гомогенный и гетерогенный катализ. При гомогенном катализе реагенты и катализатор образуют одну фазу. Например, присутствие оксида азота (II) сильно ускоряет реакцию:
2SO2 +O2 = 2SO3
в нитрозном способе получения серной кислоты. Гомогенными катализаторами часто служат растворы кислот, оснований и солей (прежде всего - солей d-элементов: Cr, Mn, Fe, Co, Ni, Cu и др.). В случае гетерогенного катализа реагенты и катализатор образуют несколько фаз. Этот вид катализа происходит на границе раздела фаз - обычно на поверхности раздела между твердой и жидкой или твердой и газовой фазами. Например, синтез аммиака из азота и водорода удалось осуществить с помощью катализатора, представляющего собой смесь металлического железа с добавками оксида калия и алюминия.
N2
+ 3H2
![]() 2NH3
2NH3
Крекинг нефти осуществляется на катализаторах, напоминающих обычную глину. Гидрирование растительного масла протекает на никелевом катализаторе (никель на кизельгуре). Действие катализаторов связано с тем, что они вступают в промежуточное взаимодействие с реагентами, направляя процесс на новый путь, характеризующийся более низким энергетическим барьером (рис.5.9).
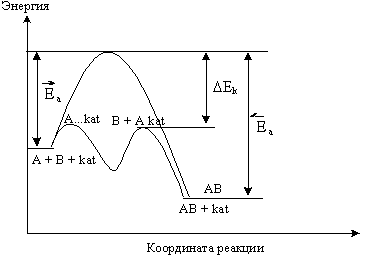
Рис.
5. 9. Влияние катализатора на снижение
барьера активации.
![]() и
и
![]() -
энергии активации прямой и обратной
реакций без катализатора. Ек
- снижение энергии активации прямой и
обратной реакций в присутствии
катализатора.
-
энергии активации прямой и обратной
реакций без катализатора. Ек
- снижение энергии активации прямой и
обратной реакций в присутствии
катализатора.
Рассмотрим самые общие представления о механизме гомогенного и гетерогенного катализа. Для объяснения механизма гомогенного катализа наибольшее распространение получила теория промежуточных соединений (предложена французским исследователем Сабатье и развита в работах Н.Д. Зелинского). Согласно этой теории медленно протекающий процесс, например, реакция
A + B = AB
в присутствии катализатора быстро протекает в две стадии:
1) A + kat = A... kat и
2) A...kat + B = [A... kat... B] = AB + kat
т.е. образуются частицы промежуточного соединения A kat, затем - активированный комплекс |A... kat... B| и конечный продукт AB с регенерацией катализатора kat. Примером может служить реакция:
2SO2 + O2 = 2SO3 медленно
в присутствии катализатора - NO - kat.
O2 + 2NO = 2NO2 быстро
2NO2 + 2SO2 = 2SO3 + 2NO быстро
Более сложен механизм гетерогенного катализа. Он связан с процессом адсорбции - явлением поглощения частиц реагента (адсорбата) поверхностью катализатора (адсорбента), (от лат. “sorbeo” - поглощаю). Различают физическую адсорбцию и химическую (хемосорбцию). При физической адсорбции частицы адсорбата и адсорбента связываются относительно непрочными межмолекулярными силами сцепления (силами Ван-дер-Ваальса). Этот процесс поэтому сопровождается небольшим отрицательным тепловым эффектом: H(298 К) = 8-20 кДж/моль и протекает обратимо.
При хемосорбции за счет сил химического взаимодействия между частицами реагента и катализатора на поверхности последнего образуется новое химическое соединение. Указанный процесс, как правило, сопровождается отрицательным тепловым эффектом, имеющим величину порядка теплового эффекта экзотермической химической реакции.
Гетерогенный катализ протекает в несколько стадий: за счет диффузии (диффузия - процесс самопроизвольного перемещения вещества, приводящий к установлению равномерного распределения концентраций в объеме) частицы реагентов подводятся к катализатору, и его поверхность адсорбирует их. При этом происходит процесс концентрирования вещества реагентов из объема газовой фазы на поверхности катализатора, что сопровождается сближением частиц реагентов и повышением - под влиянием силового поля поверхностных частиц катализатора - их химической активности; изменяется электронная структура взаимодействующих частиц и, как следствие, понижается активационный барьер. В результате на поверхности катализатора протекает реакция с высокой скоростью. Таким образом, промежуточными в гетерогенном катализе являются поверхностные соединения. Затем происходит десорбция продуктов взаимодействия с поверхности катализатора и их переход (за счет диффузии) в объем. Учение о гетерогенном катализе отражено в исследованиях А.А. Баландина (мультиплетная теория), Н.И. Кобозева (теория активных ансамблей), Н.Н. Семенова и В.В. Воеводского (радикальная и цепная теория), Ф.Ф. Волькенштейна и др. ученых (электронная теория катализа).
Скорость реакции зависит от многих причин. На нее влияют: а) природа реагентов и б) условия проведения процесса: концентрация реагентов, давление (для реакций с участием газов), температура, катализатор, примеси и их концентрации, среда (для реакций в растворах), форма реакционного сосуда (в цепных реакциях), интенсивность света (в фотохимических реакциях), мощность дозы излучения (в радиационно-химических процессах) и др. Основными факторами, которые приходится учитывать во всех процессах, являются концентрации (давления) реагентов, температура и действие катализатора. Рассмотрим влияние каждого из указанных факторов на скорость реакции.
