
- •2.3 Випарні установки
- •2.3.1. Технологічні якості розчинів
- •2.3.2. Технічні способи випарювання розчинів
- •2.3.3. Випарні апарати
- •2.3.4. Плівкові випарні апарати і випарювачі
- •2.3.5. Сепарація пару
- •2.3.6. Барометричні конденсатори
- •2.3.7. Циркуляційні нагнітачі
- •2.3.8. Тепловий розрахунок випарних установок
- •2.3.9. Адіабатні випарні установки
- •2.3.10. Випарні установки з контактними нагрівачами
- •2.3.11. Випарні апарати з погрузними горілками
2.3 Випарні установки
2.3.1. Технологічні якості розчинів
Випарювання – термічний процес концентрування розчинів твердих нелетучих речовин при кипінні і видаленні рідкого летучого розчинника у вигляді парів.
Випарювання застосовують для концентрування розчинів у виробництві мінеральних солей, органічних полу продуктів і удобрень, білково-вітамінних концентратів, кормових дрожів і інших продуктів, а також для регенерації різних розчинів (з метою повернення їх в технологічний цикл) і термічного обезвожування промислових стоків.
Концентрацією
чи складом розчину в техніці прийнято
називати масову кількість розчинених
твердих речовин у визначені масові чи
об’ємній кількості розчину чи розчинника
(води). Якщо позначити через b
кількість (кг) твердої речовини в 1 кг
розчину, через
![]() кількість кг твердої речовини в 1 кг
води, то b
і
кількість кг твердої речовини в 1 кг
води, то b
і
![]() будуть пов’язані між собою наступною
залежністю:
будуть пов’язані між собою наступною
залежністю:
![]() . (1)
. (1)
Процентну
концентрацію b
можна виразити через маси сухої речовини
![]() і розчинника W,
кг, у наступному вигляді:
і розчинника W,
кг, у наступному вигляді:
![]() . (2)
. (2)
Розчин, в якому міститься гранична кількість розчиненої речовини, називають насиченим.
Кількість розчиненої речовини в насиченому розчині, віднесена до певної кількості розчину чи розчинника, називається розчинністю.
Криві розчинності деяких солей у вигляді залежності від температури показані на рис. 2.30 і 2.31. Зміна тиску практично не впливає на розчинність солей у воді.
При кипінні розчину у випарному апараті температура пара, який виділяється, завжди менше температури кипіння розчину. Ця різниця температур тим більше, чим концентрованіше розчин; її називають температурною депресією і позначають
![]() ,
,
де
![]() - температура кипіння розчину,
- температура кипіння розчину,
![]() ;
;
![]() -
температура парів розчинника (води),
які виділилися,
-
температура парів розчинника (води),
які виділилися,
![]() .
.
Температурна депресія збільшується з підвищенням концентрації розчина і різна для різних розчинів. На рис. 2.32 приведені нормальні температурні депресії водних розчинів деяких речовин при атмосферному тиску (0,1 МПа). Для розрахунку температурної депресії водних розчинів при тисках, які відрізняються від нормального, при наявності даних із таблиць для нормальної депресії користуються формулою
![]() ,
(3)
,
(3)
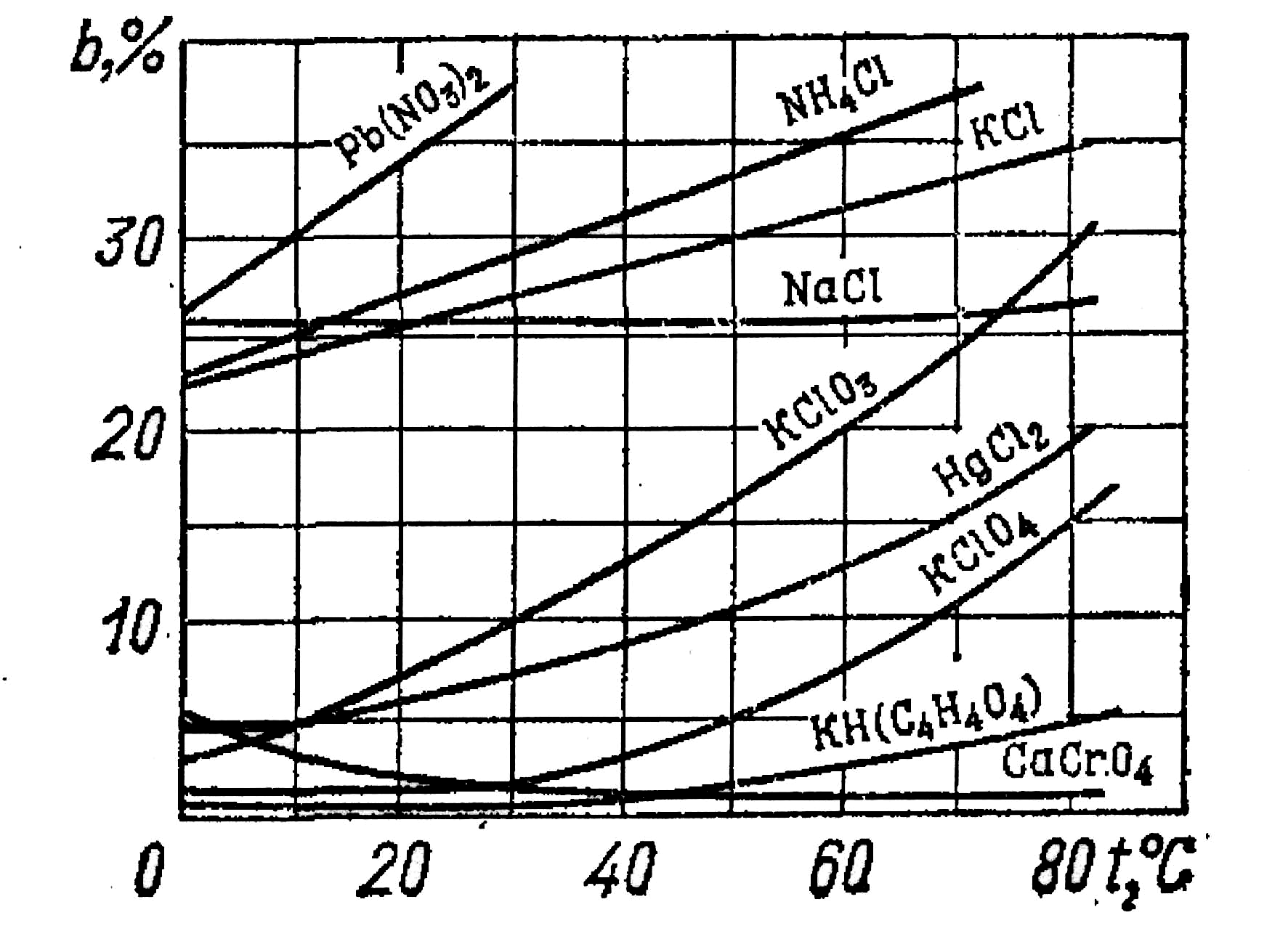
Рис. 2.30. Криві розчинності деяких солей, які утворюють в даному температурному інтервалі безводні осадки

Рис. 2.31. Криві розчинності деяких солей, які утворюють в даному температурному інтервалі осадки солей з кристалізаційною водою
де
![]() - температурна депресія при даному
тиску,
- температурна депресія при даному
тиску,
![]() ;
;
![]() - температурна депресія при атмосферному
тиску,
- температурна депресія при атмосферному
тиску,
![]() ;
Т – температура кипіння води при даному
тиску, К; r
– теплота пароутворення води при даному
тиску, кДж/кг.
;
Т – температура кипіння води при даному
тиску, К; r
– теплота пароутворення води при даному
тиску, кДж/кг.
Розчини в процесі випарювання наряду з температурною депресією міняють і інші свої фізичні якості. З підвищенням концентрації збільшується густина і в’язкість, знижуються теплоємність, теплопровідність і коефіцієнт тепловіддачі, змінюється в ту чи іншу сторону теплота розчинення.
Густину розчину можна визначити по формулі
![]() , (4)
, (4)
де
![]() - густина безводної нелетучої речовини,
кг/м
- густина безводної нелетучої речовини,
кг/м![]() ;
;
![]() - густина розчинника (води), кг/м;
b
– масовий
вміст речовини в розчині, %.
- густина розчинника (води), кг/м;
b
– масовий
вміст речовини в розчині, %.
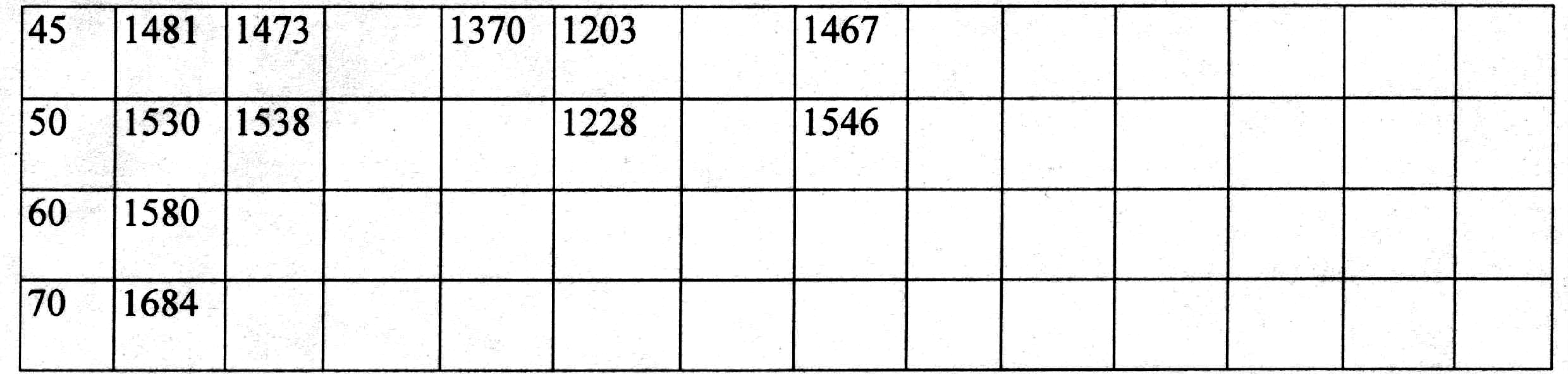
Густина розчинів деяких речовин в залежності від концентрації надана в табл. 2.39.
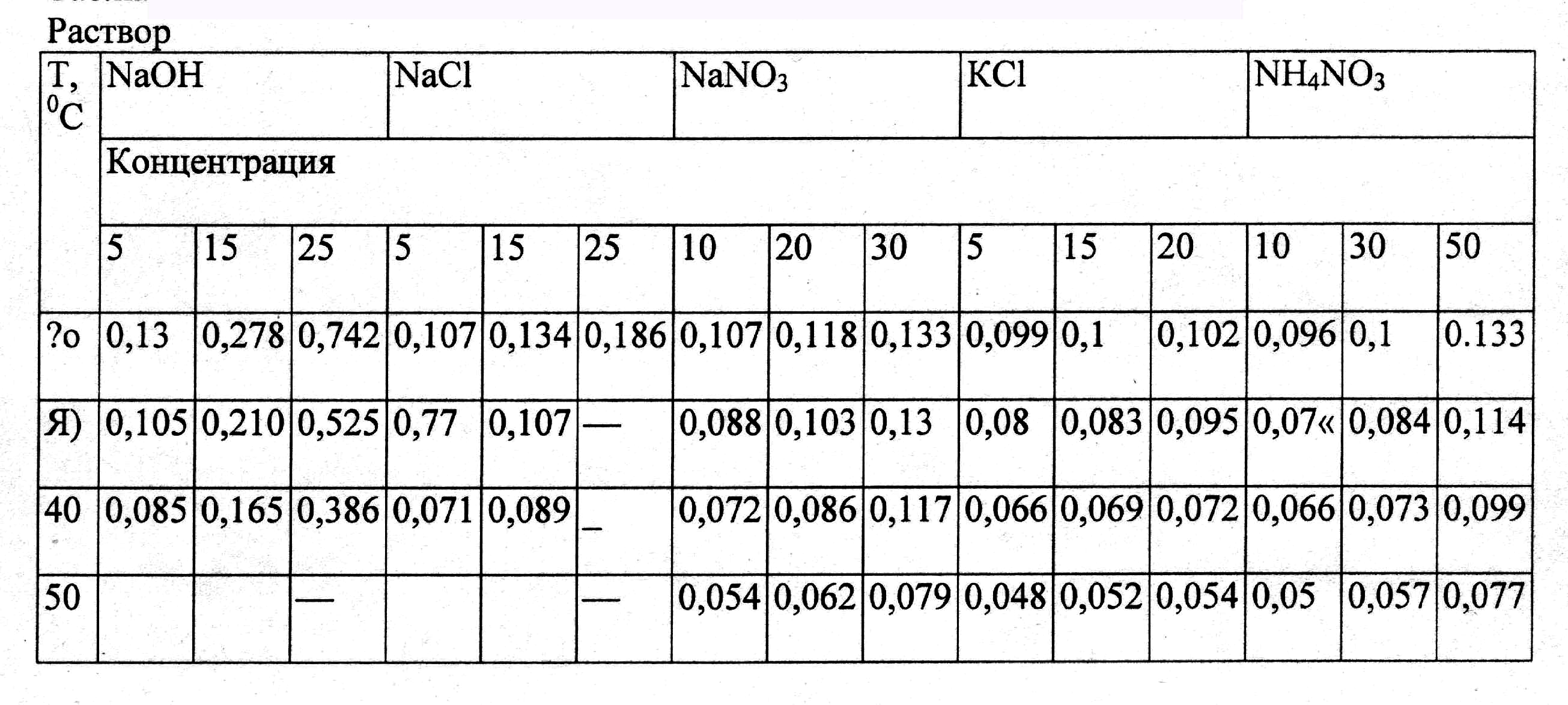
В’язкість всіх розчинів знаходиться у великій залежності від температури і зменшується з її підвищенням. Численні значення динамічної і кінематичної в’язкості розчинів даються у довідковій і спеціальній літературі. Динамічна в’язкість деяких водних розчинів в залежності від концентрації і температури приведена в табл.. 2.40.
Таблиця 2.39.
Густини
розчинів деяких речовин р в залежності
від
масової концентрації, % (при 20![]() )
)

Таблиця 2.40.
Динамічна в’язкість (л(Па-с) деяких водних розчинів
.
Зміна відносної в’язкості в залежності від концентрації для деяких розчинів приведена на рис. 2.33.
Питому
теплоємність розчину
![]() можна визначити по формулі
можна визначити по формулі
![]() , (5)
, (5)
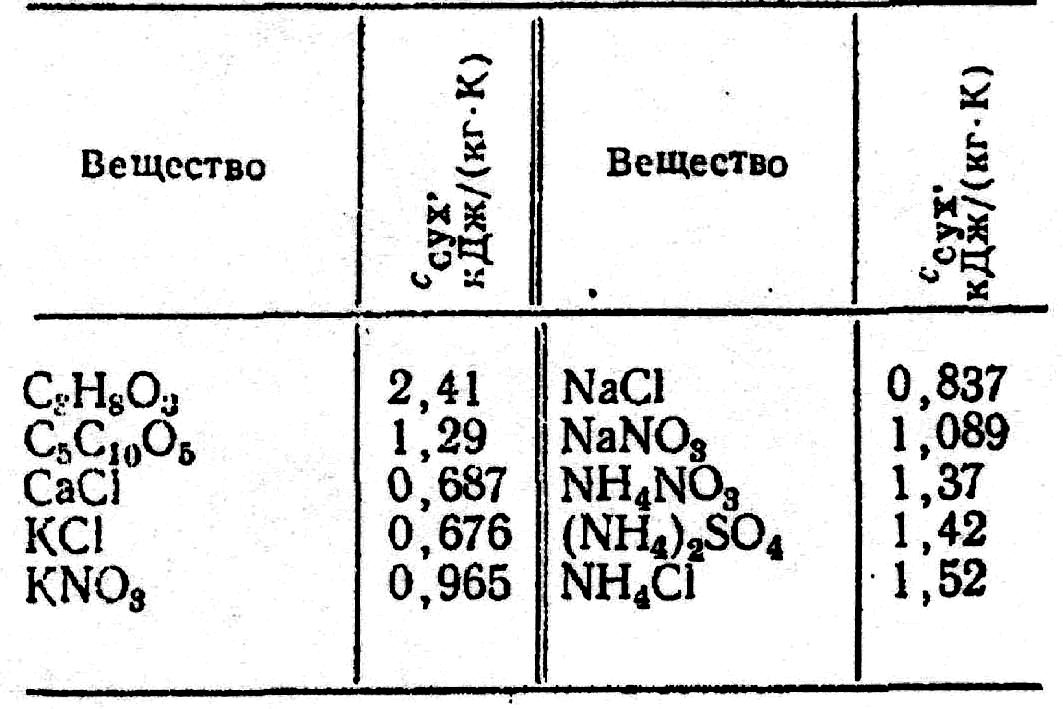
де
![]() - масова питома теплоємність безводної
нелетучої речовини в розчині, кДж/(кг
К), (табл. 2.41);
- масова питома теплоємність безводної
нелетучої речовини в розчині, кДж/(кг
К), (табл. 2.41);
![]() - масова питома теплоємкість води при
20
- масова питома теплоємкість води при
20![]() ,
рівна 4,186 кДж/(кг
К); b
– масовий
вміст речовини в розчині, %.
,
рівна 4,186 кДж/(кг
К); b
– масовий
вміст речовини в розчині, %.
Таблиця 2.41.
Масова
питома теплоємність
![]() сухих (безводних) речовин
сухих (безводних) речовин
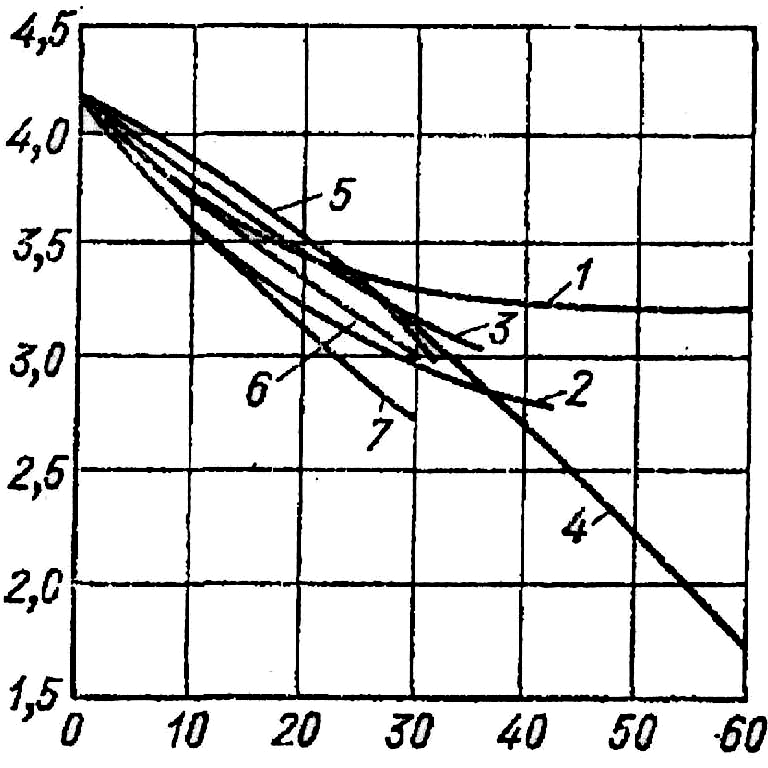
Для розчинів теплоємкість не має адитивних якостей і не може бути достатньо точно вирахувана по формулі (2.43). Відхилення від якостей адитивності тим більше, чим більше концентрація розчиненої речовини. Тому в точних розрахунках доцільно використовувати дослідні значення теплоємкості розчинів, які приведені у вигляді таблиць чи графіків (рис. 2.34).
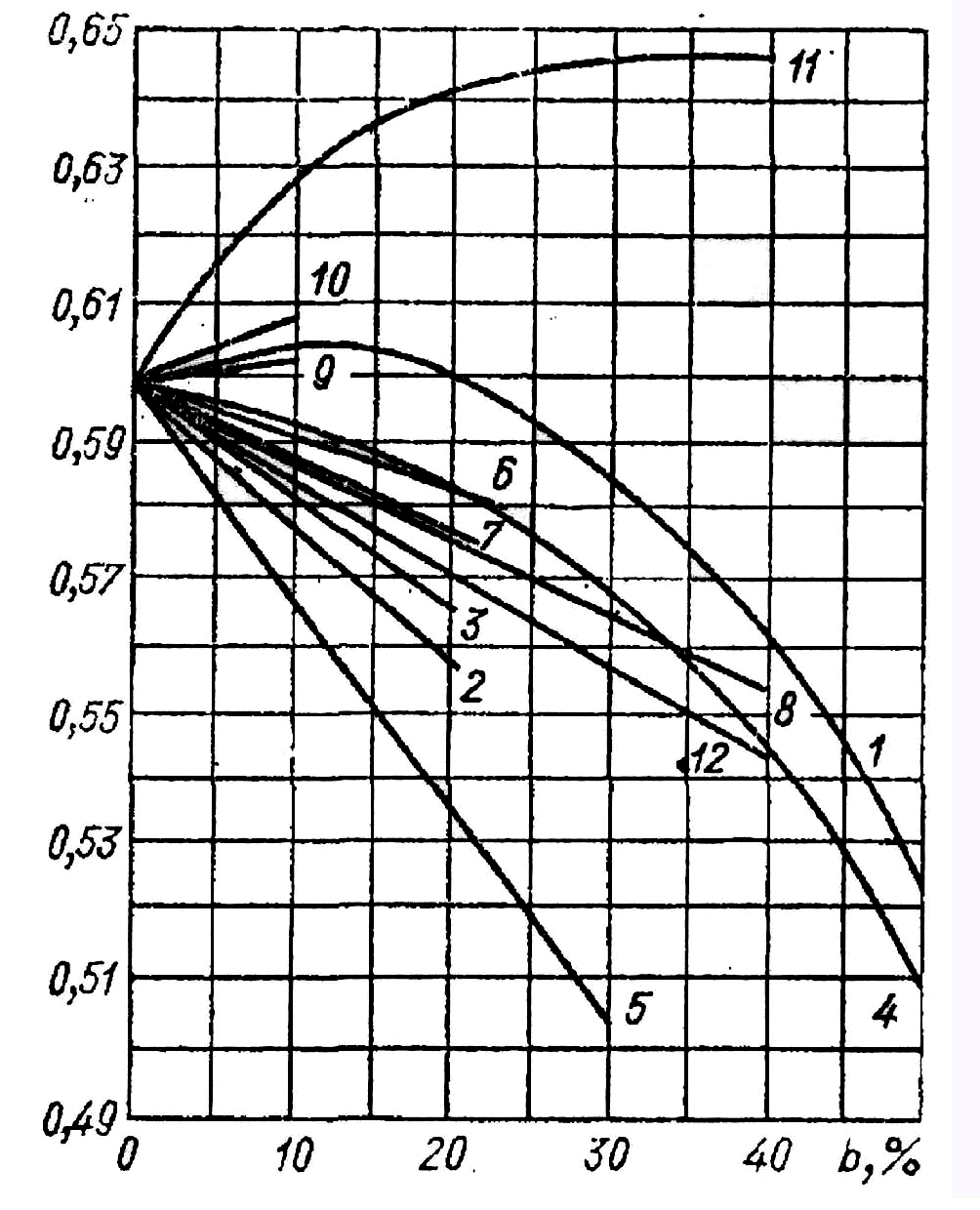
Теплопровідність розчинів за рідким винятком з ростом концентрації розчиненої речовини зменшується (рис. 2.35). Теплопровідність води має позитивний температурний хід, тому при малих концентраціях теплопровідність водних розчинів багатьох солей, кислот і луг з підвищенням температури росте.
-
Теплоємність, С, кДж/(кгград), при 20оС
Концентрація розчину b, %
Рис. 2.34. Зміна масової теплоємкості розчинів деяких солей в залежності від концентрації розчина:
1 – NaOH; 2 – KOH; 3 –
![]() ;
4 - NaN
;
4 - NaN![]() ;
5 -
;
5 -
![]() ;
6 -
;
6 -
![]() ;
7 - Ca
;
7 - Ca![]() .
.
-
Теплопровідність, , Вт/(мК)
Концентрація розчину
Рис. 2.35. Теплопровідність
деяких розчинів в залежності від
концентрації при 20![]() :
:
1 – КОН; 2 – KCl; 3 - K![]() ;
4 -
;
4 -
![]() ;
5 - Mg
;
5 - Mg![]() ;
6 - Mg
;
6 - Mg![]() ;
7 – NaCl; 8 - Na
;
7 – NaCl; 8 - Na![]() ;
9 -
;
9 -
![]() ;
10 -
;
10 -
![]() ;
11 – NaOH; 12 - CaC
;
11 – NaOH; 12 - CaC![]() .
.
-
Інтегральна теплота розчинення, q, кДж/кг, твердої речовини при 18оС

Концентрація розчину b, %
Рис. 2.36. Інтегральна теплота розчину деяких речовин:
1 – NaOH; 2 – KOH; 3 -
![]() ;
4 - Na
;
4 - Na![]() ;
5 -
;
5 -
![]() ;
6 -
;
6 -
![]() ;
7 - Ca
;
7 - Ca![]() .
.
Таблиця 2.42.
Поверхневе
натягання
![]() ,
кПа/м,
деяких водних розчинів
в
залежності від концентрації розчину
,
кПа/м,
деяких водних розчинів
в
залежності від концентрації розчину
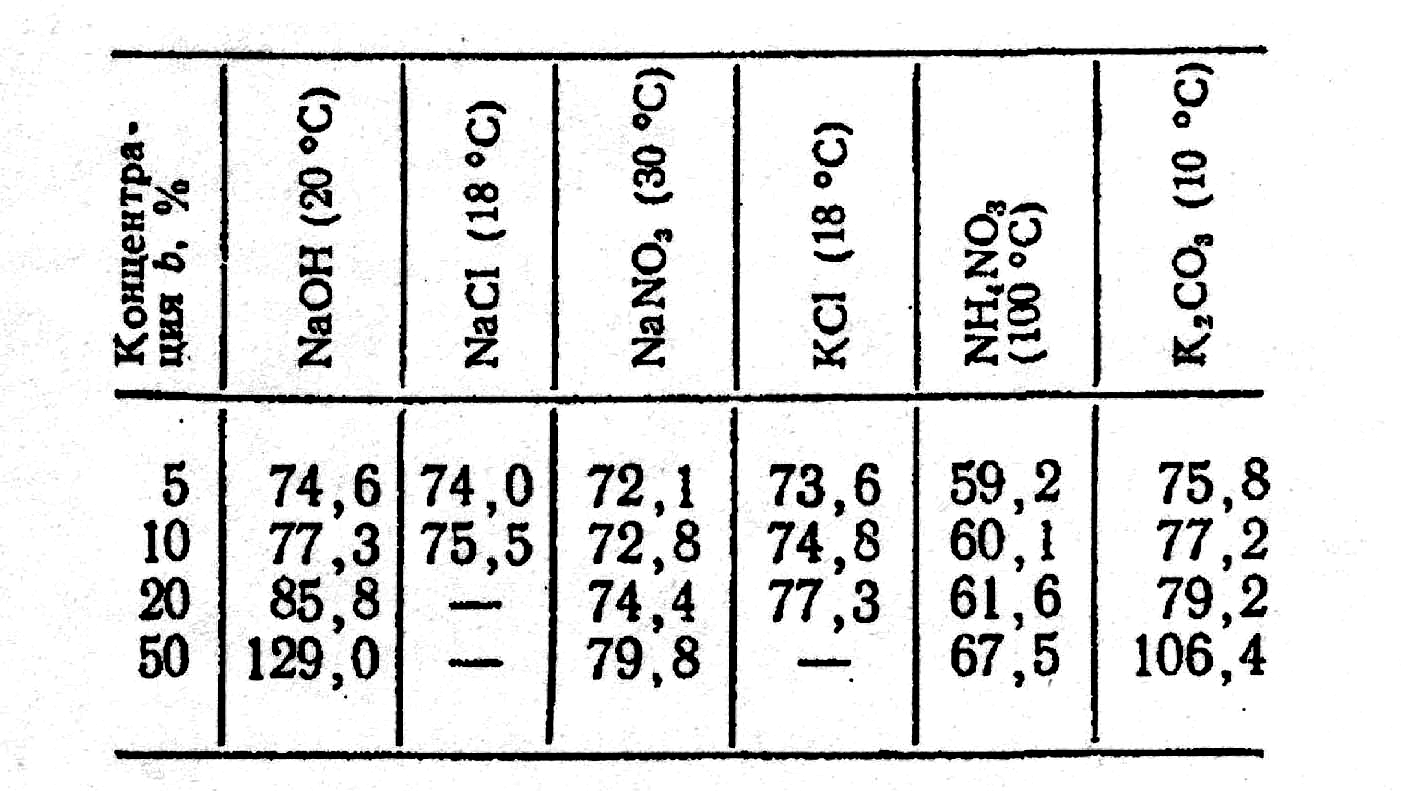
Поверхневе
натягання
![]() деяких водних розчинів в залежності
від концентрації приведена в табл. 2.42,
інтегральна теплота розчинення – на
рис. 2.36.
деяких водних розчинів в залежності
від концентрації приведена в табл. 2.42,
інтегральна теплота розчинення – на
рис. 2.36.
