- •Кафедра химии
- •Лабораторная работа № 1
- •1.1 Теоретические основы метода
- •1.3 Приборы и реактивы:
- •1.4 Химические основы фотометрического определения ионов железа (III) в виде роданидных комплексов
- •1.5 Порядок выполнения работы
- •1.6 Обработка полученных результатов
- •1.7 Результаты работы
- •Лабораторная работа №2 Рефрактометрическое определение концентрации сахарозы
- •2.3 Основы метода:
- •2.4 Порядок выполнения работы
- •2.6 Результаты работы
- •Список литературы
- •Вопросы к защите лабораторных работ
- •Уметь решать следующие задачи:
Министерство образования Республики Беларусь
Учреждение образования
МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПРОДОВОЛЬСТВИЯ
Кафедра химии
Лабораторные работы
по дисциплине «Аналитическая химия»
по теме:
ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Специальность 1 - 49 01 02 «Технология хранения и переработки животного сырья»
Специализация: 1 - 49 01 02 02 Технология молока и молочных продуктов
Проверил Выполнили
Автушенко В.В. студенты группы ТЖМ – 101
___________________________ _______________________________
«_____» ______________ 2011 г. _______________________________
_______________________________
«_____» ____________________ 2011 г.
Могилев 2011
Лабораторная работа № 1
Фотоэлектроколориметрическое определение ионов Fe3+ в виде роданидного комплекса
1.1 Теоретические основы метода
Фотоэлектроколориметрия основана на поглощении света определяемым веществом в видимой части спектра (400–760 нм). Интенсивность светового потока при его прохождении через исследуемую среду уменьшается вследствие превращения энергии излучения в различные формы внутренней энергии вещества и (или) в энергию вторичного излучения. Поглощательная способность вещества зависит от электронного строения атомов и молекул, а также от длины волны и поляризации падающего света, толщины слоя, концентрации вещества, температуры. Для измерения поглощательной способности в данном методе используют фотоэлектроколориметры – оптические приборы, состоящие из источника света, камеры для образцов, монохроматора (призма или дифракционная решетка) и детектора.
Применение фотоэлектроколориметрии основано на основном законе светопоглощения, или законе Бугера-Ламберта-Бера, который связывает уменьшение интенсивности света с концентрацией раствора и толщиной слоя. Согласно закону Бугера-Ламберта-Бера, растворы одного и того же окрашенного вещества при одинаковой концентрации этого вещества и одинаковой толщине слоя раствора поглощают равное количество световой энергии, т.е. светопоглощение таких растворов одинаково.
Этот закон выражается уравнением:
![]() 1
1
где I – интенсивность света прошедшего через раствор; I0 – интенсивность падающего на раствор света; ε – молярный коэффициент поглощения; С – молярная концентрация окрашенного вещества в растворе, моль/л; l – толщина слоя светопоглощающего раствора, см.
После логарифмирования и смены знаков на обратные, уравнение (1) принимает следующий вид:
![]() 2
2
Величина lg I0/I является важной характеристикой окрашенного раствора; ее называют оптической плотностью и обозначают буквой D или А, тогда:
![]() 3
3
Из этого уравнения следует, что оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Для определения концентрации анализируемого иона обычно используют следующие методы: метод добавок и метод калибровочного графика.
Метод добавок основан на сравнении оптической плотности исследуемого раствора и того же раствора с добавкой известного количества стандартного раствора определяемого вещества. Для определения неизвестной концентрации используют два способа.
-
Расчет по уравнению:
![]() 4
4
где Са – концентрация добавки в фотометрируемом растворе; Dх – оптическая плотность исследуемого раствора без добавки стандартного раствора; Dх+а – оптическая плотность исследуемого раствора с добавкой стандартного раствора.
-
Графический способ
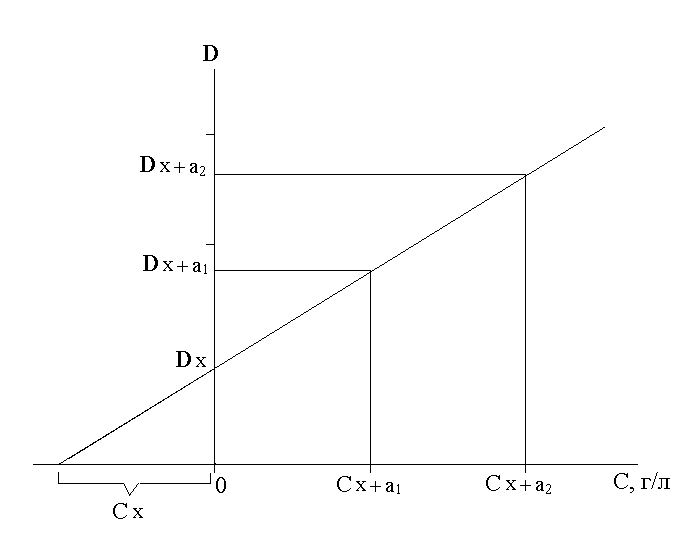
При определении неизвестной концентрации графическим способом на оси ординат откладывают значения оптической плотности исследуемого раствора Dх (без добавки) и оптические плотности исследуемого раствора с двумя добавками Dх+а1 и Dх+а2, а на оси абсцисс – концентрации добавленного вещества Са1 и Са2 в анализируемом растворе.
Через полученные точки проводят прямую (рисунок 1) до пересечения с осью абсцисс в точке Сх. Абсолютное значение отрезка 0Сх выражает неизвестную концентрацию исследуемого раствора.
|
|
|
Рисунок 1 – Графическое определение концентрации анализируемого иона методом добавок |
Метод добавок применяют для определения малых количеств различных элементов в присутствии больших количеств посторонних.
Метод калибровочного графика. При использовании метода калибровочного графика готовят серию стандартных растворов с различной концентрацией определяемого иона и измеряют их оптическую плотность. Согласно основному закону светопоглощения между концентрацией C и оптической плотностью D существует прямолинейная зависимость, причем, если С = 0, то и D = 0 (рисунок 2):
|
|
|
Рисунок 2 – Калибровочный график для определения концентрации анализируемого иона методом фотоэлектроколориметрии |
Измерив оптическую плотность исследуемого раствора Dх, находят ее значение на оси ординат, а затем на оси абсцисс соответствующее значение Сх.
Метод калибровочного графика применяют при выполнении серийных анализов. Этот метод позволяет определить концентрацию растворов даже в том случае, когда основной закон светопоглощения не соблюдается.
1.2 Цель работы: определить содержание Fe3+ в виде роданидного комплекса в растворе методом калибровочного графика.