- •Тема 1. Закономірності зовнішньої форми кристалів
- •Макроскопічний та мікроскопічний підходи до вивчення стану речовини
- •Поняття про кристали. Властивості кристала
- •Закономірності зовнішньої форми кристалів
- •Закон постійності кутів кристала (закон Стено (XVI cт.)
- •Основні поняття і висновки, які слід запам’ятати:
- •Тема 5. Структура і властивості кристалічних тіл
- •Класифікація кристалів за ознакою виду їх часток.
- •Приклади кристалічних структур
Тема 5. Структура і властивості кристалічних тіл
-
Класифікація кристалів за ознакою виду їх часток.
-
Приклади кристалічних структур.
-
Особливості фізичних властивостей кристалів.
-
Класифікація кристалів за ознакою виду їх часток.
За видами часток, з яких побудований кристал, і за характером сил взаємодії між частками всі кристали можна поділити на 4 групи: іонні, атомні, металеві та молекулярні.
Іонні кристали. Будівельними частками іонних кристалів є протилежно заряджені іони. Взаємне притягання між ними створює іонний зв’язок. Типовими іонними кристалами є NaCl, CsCl, CdF2. До іонних кристалів відносяться також деякі інтерметалічні сполуки: AuZn, MgAg, CdAg. Іонні кристали слабо розширюються при нагріванні і мають високу точку плавлення, що свідчить про велику міцність іонного зв’язку.
Чим більший заряд іона, тим вище температура плавлення іонного кристала. Наприклад, NaCl плавиться при температурі ~ 800 °С, а температура плавлення СаО досягає 2570 °С.
Іонні кристали не проводять електричний струм, тому що їх електрони міцно утримуються на орбітах іонів. Проте при нагріванні іонні кристали стають провідними з іонною електропровідністю. Наприклад, якщо кристал NaCl затиснути між двома електродами і розмістити його у нагрівальній печі, з’єднавши електроди з джерелом постійного струму, то при температурах 500 – 550 °С іони Na+ почнуть рухатись до катоду.
Атомні кристали. Атомні кристали утворюються атомами, які пов’язані один з одним гомеополярними (ковалентними зв’язками, що утворюються внаслідок того, що у двох або кількох сусідніх атомів створюються усуспільнені («колективізовані») електрони.
Приклад атомного кристала – алмаз. Атомні кристали подібно до іонних не проводять електричний струм, але на відміну від іонних лишаються непровідними не тільки при високих температурах, а навіть у розплаві.
Металічні кристали. Метали являють собою позитивні іони, що оточені середовищем вільних електронів, які пересуваються хаотично. Таким чином, метал можна спрощено уявити як іонний «каркас», що занурений в «електронний газ».
Метали відрізняються від інших кристалічних тіл високими теплопровідністю та електропровідністю, оптичною непрозорістю та високою відбивальною здатністю.
Молекулярні кристали. Молекулярні кристали утворюються молекулами, що пов’язані одна з одною силами взаємодії між молекулярними диполями, які звуться «ван-дер-ваальсовими».
Приклад молекулярного кристала – нафталін (рис. 5.1).
Н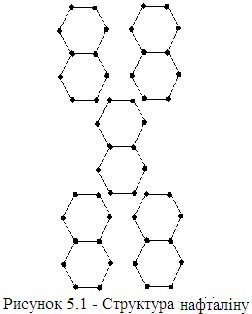 изька
точка плавлення (~ 80 °С), м’якість
свідчать про те, що зв’язок
такого виду дуже слабкий.
изька
точка плавлення (~ 80 °С), м’якість
свідчать про те, що зв’язок
такого виду дуже слабкий.
-
Приклади кристалічних структур
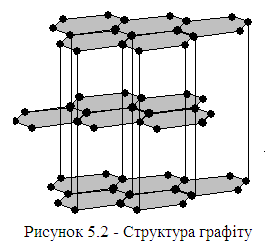
Структура графіту (рис. 5.2). У деяких твердих тілах може одночасно існувати декілька видів зв’язку. Прикладом є шарувата структура графіту. Плоскі шари пов’язані один з одним ван-дер-ваальсовими силами, а в межах шару три валентні електрони кожного атома вуглецю утворюють гомеополярний зв’язок із сусідніми атомами, а четвертий електрон лишається вільним («сколективізується»), як у металах (тільки в межах одного шару).
Таким чином, в кристалах графіту існує зв’язок трьох видів: гомеополярний, металічний і ва-дер-ваальсовий.
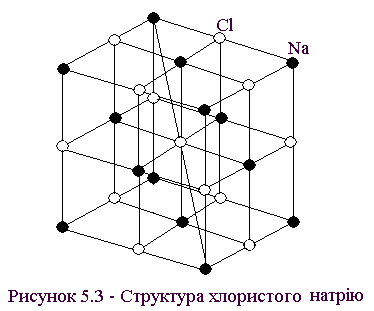
Структура хлористого натрію (рис. 5.3). Решітка – кубічна, гранецентрована. Аналогічну структуру мають кристали KBr, RbJ, PbS, AgBr, MgO.
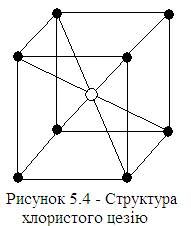
Cтруктура хлористого цезію (рис. 5.4). Решітка – проста, кубічна. Структуру хлористого цезію можна уявити у вигляді двох простих решіток, що зміщені одна відносно другої у напрямі [111] на половину довжини діагоналі куба, причому вузли однієї решітки зайняті іонами цезію, а вузли іншої – іонами хлору.