
- •400066, Волгоград, пл. Павших Борцов, 1
- •Правила по технике безопасности при работе в химической лаборатории
- •Глава 1. Номенклатура и изомерия органических соединений.
- •§ 1.1. Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •§ 1.2. Основы строения и реакционной способности оргаических соединений
- •§ 1.2.1. Общая характеристика органических соединений
- •§ 1.2.2. Классификация органических соединений
- •§ 1.2.3. Номенклатура.
- •§ 1.2.3.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •§ 1.2.3.2. Радикально-функциональная номенклатура
- •Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
- •§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
- •Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
- •§ 2.1. Пространственное строение органических соединений. Стереоизомерия
- •§ 2.2. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Электронные эффекты заместителей
- •§ 2.3. Системы с замкнутой цепью сопряжения.
- •§ 2.4. Гетероциклические ароматические соединения.
- •§ 2.5. Кислотно-основные свойства органических соединений. Типы кислот и оснований. Определение понятий «кислота» и «основание».
- •§ 2.5.1. Кислоты и основания по Бренстеду
- •Значение рКа некоторых кислот Бренстеда
- •Основания Бренcтеда.
- •Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
- •§ 2.5.2. Льюисовская кислотность и основность органических соединений.
- •§ 2.5.3. Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Классификация кислот и оснований по Пирсону
- •Глава 3. Механизмы реакций органических соединений.
- •§ 3.1. Классификация органических реакций и их компонентов.
- •§ 3.2. Основные типы органических реакций
- •§ 3.3. Механизмы реакций в органической химии
- •§ 3.3.1. Реакции радикального замещения - sr
- •§ 3.3.2. Реакции нуклеофилъного замещения у тетрагонального атома углерода (sn)
- •§ 3.3.3. Реакции элиминирования ( е1 и е2).
- •§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
- •§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •§ 4.1. Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •§4.2. Химические свойства альдегидов и кетонов.
- •§ 4.3. Альдегиды и их производные
- •§ 4.3. Лабораторный практикум.
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
- •§ 5.2. Химические свойства предельных кислот и их производных
- •§ 5.3. Кислотно-основные свойства.
- •§ 5.4. Карбоновые кислоты как ацилирующие реагенты
- •Реакции декарбоксилирования
- •§ 5.5. Производные карбоновых кислот, их свойства и взаимные превращеия
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •§ 5.6. Отдельные представители амидов кислот.
- •§ 5. 7. Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •§ 5.8. Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •§ 5.9. Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Биологически активные гетерофункциональные соединения.
- •§ 6.1. Классификация поли- и гетерофункциональных соединений
- •§ 6.2. Общая характеристика реакционной способности
- •Специфические реакции.
- •§ 6.3. Аминоспирты
- •§ 6.4. Гидроксикарбоновые кислоты
- •§ 6.5. Оксокарбоновые кислоты
- •§ 6.6. Фенолокислоты. Особенности строения, свойства и биологическая роль.
- •Отдельные представители фенолокислот.
- •§ 6.7. Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически активные гетероциклические соединения.
- •§ 7.1. Понятие о гетероциклических соединениях
- •§ 7.1.1. Пятичленные гетероциклы.
- •§ 7.1.2. Шестичленные гетероциклы.
- •§ 7.1.3. Бициклические гетероциклы.
- •§7.2. Лабораторный практикум.
- •Ход работы.
- •Глава 8. Аминокислоты, пептиды, белки
- •§ 8.1.Строение и свойства аминокислот.
- •§ 8.2. Пептиды.
- •§ 8.3. Качественные реакции на аминокислоты и белки.
- •§ 8.4. Физиологическая роль и применение в медицине некоторых аминокислот
- •§ 8.5. Белки
- •1. Каталитическая функция
- •7. Защитная функция
- •§ 8.6. Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •§ 9.1. Строение и свойства углеводов.
- •§ 9.1. 1. Классификация углеводов.
- •§9.1.2. Изомерия моносахаров.
- •§9.1.3. Химические свойства моносахаридов.
- •§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара)
- •§ 9.3. Олиго- и полисахариды.
- •§ 9.3.1. Полисахариды.
- •§ 9.4. Гетерополисахариды
- •§ 9.5. Функции углеводов и их обмен
- •§ 9.6. Роль углеводов в развитии кариеса зубов
- •Контрольные вопросы
- •§ 9.7. Лабораторная работа «Свойства простых и сложных углеводов»
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •§ 10.1. Нуклеиновые основания, нуклеозиды, нуклеотиды.
- •§ 10.2. Нуклеотидный состав и структура днк и рнк.
- •§10.3. Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •§ 10.4. Лабораторная работа. «Гидролиз нуклеиновых кислот»
- •Глава 11. Омыляемые и неомыляемые липиды.
- •§ 11.1. Липиды. Строение и классификация липидов
- •§ 11.2. Простые липиды
- •§ 11.2.1. Жиры
- •Константы некоторых жиров животного и растительного происхождения
- •§ 11.2.2. Воски
- •§ 11.2.3. Стериды. Стероиды и стероидные гормоны.
- •§11.2.4.Желчные килоты
- •Стероидные гормоны
- •§ 11.3. Сложные липиды
- •§ 11.4. Лабораторный практикум «Омыляемые и неомыляемые липиды. Терпеноиды и стероиды»
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •§ 12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •§ 12.2. Поверхностная активность веществ.
- •§ 12.3. Адсорбция.
- •2. Изотерма Ленгмюра:
- •§12.4. Лабораторный практикум «Адсорбция поверхностно-активного вещества на границе раздела жидкость-воздух или жидкость-жидкость».
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •§ 13.1. Адсорбция на границе твердое тело — раствор. Влияние различных факторов на величину адсорбции.
- •§ 13.1.1. Молекулярная адсорбция.
- •§13.1.2. Адсорбция сильных электролитов.
- •§13.2. Адгезия и когезия.
- •Задание для самостоятельной подготовки
- •Контрольные вопросы
- •§13.3. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •§ 14.1. Дисперсные системы и их классификация.
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •§ 14.2. Получение и устойчивость дисперсных систем
- •§ 14.3. Строение мицелл.
- •§ 14.4. Слюна как дисперсная система.
- •§ 14.5. Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
§ 14.3. Строение мицелл.
Структурную единицу коллоидного раствора называют мицеллой. Множество формульных единиц (до нескольких тысяч), соединяясь вместе, образуют агрегат. Ионы, сообщающие поверхности агрегата определенный заряд, называют потенциалопределяющими ионами. Потенциалопределяющие ионы удерживаются на поверхности агрегата за счет межмолекулярных взаимодействий. Агрегат вместе со слоем потенциалопределяющих ионов принято называть ядром коллоидной частицы. Противоионы имеют знак заряда, противоположный потенциалопределяющим ионам.
На противоионы со стороны ядер коллоидных частиц действует электростатическое притяжение. В то же время противоионы могут принимать участие в тепловом движении как кинетически самостоятельные единицы.
Таким образом, одни противоионы достаточно прочно связаны с поверхностью ядер, вместе с потенциалопределяющими ионами они образуют адсорбционный слой. Другие противоионы образуют диффузный слой. Агрегат вместе с адсорбционным слоем образует гранулу мицеллы. Знак заряда гранулы определяется знаком заряда потенциалопределяющих ионов, а размер заряда — толщиной диффузного слоя. Чем меньше диффузный слой, тем больше противоионов находится в адсорбционном слое и тем меньше заряд. Гранула и противоионы диффузного слоя образуют мицеллу. Мицелла электронейтральна.
Рассмотрим строение мицелл золей, образующихся в результате взаимодействия растворов нитрата серебра и йодида калия. Золь можно получить в условиях избытка либо нитрата серебра, либо йодида калия:
AgNO3 + KI → KNO3 + AgI ↓
-
Частицы золя, полученного при избытке нитрата серебра, положительно заряжены. После того как образуются агрегаты AgI, в растворе останутся ионы К+, NО3- и Аg+. В соответствии с правилом Панета— Фаянса кристаллическую решетку йодида серебра из присутствующих в растворе ионов могут достроить только ионы серебра. Они и сообщают поверхности агрегатов положительный заряд. Противоионами в рассматриваемом примере являются нитрат-ионы. Схема строения мицеллы такого золя имеет вид:

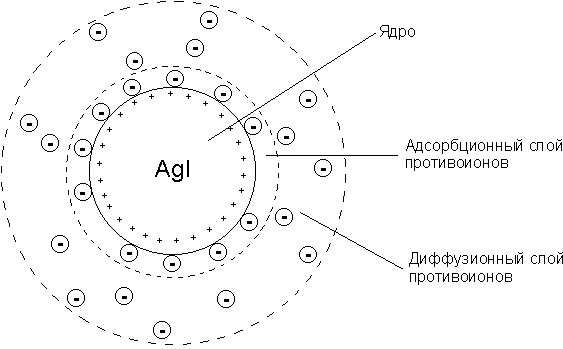
где m — число формульных единиц AgI в агрегате; п — число потенциалопределяющих ионов; x— число противоионов в составе диффузного слоя.
2. Частицы золя, полученного при избытке йодида калия, отрицательно заряжены. После того как образуются агрегаты AgI, в растворе останутся ионы К+, NO3- и I- . В соответствии с правилом Панета—Фаянса кристаллическую решетку йодида серебра из присутствующих в растворе ионов могут достроить только йодид-ионы (потенциалопределяющие ионы). Противоионами являются ионы калия. Схема строения мицеллы такого золя имеет вид:
{ m [AgI] · nI– · (n-x)K+}x– · x K+
В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы (это твердая фаза). Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
В мицелле с ионным стабилизатором, как во всякой гетерогенной системе, в которой на границе раздела фаз имеется двойной электрический слой, различают два потенциала: межфазный φмф и электрокинетический, или ζ - потенциал ( дзета – потенциал).
Межфазным потенциалом называется потенциал ДЭС на границе раздела между твердой и жидкой фазами в мицелле.
Электрокинетическим потенциалом ( ζ - потенциалом ) называется потенциал на границе скольжения между адсорбционной и диффузионной частями ДЭС мицеллы.
Наличие электрического заряда на поверхности коллоидных частиц обусловливает их способность к электрофорезу.
Электрофорезом называют перемещение в электрическом поле частиц дисперсной фазы относительно дисперсионной среды. Частицы с положительным зарядом перемещаются к катоду, с отрицательным – к аноду.
Дисперсные системы в отличие от истинных растворов термодинамически неустойчивы. Под устойчивостью системы понимают ее способность сохранять во времени все параметры без обмена энергией и веществами с окружающей средой.
Устойчивость дисперсных систем.
Различают седиментационную и агрегативную устойчивость дисперсных систем.
Седиментационная устойчивость — это устойчивость частиц к оседанию под действием силы тяжести; седиментационно неустойчивые системы с течением времени расслаиваются: легкие частицы всплывают на поверхность, а тяжелые – оседают на дно.
Агрегативная устойчивость — это способность дисперсных систем сохранять размер частиц и их индивидуальность. В агрегативно неустойчивых системах проходят процессы укрупнения частиц.
Грубодисперсные системы седиментационно неустойчивы. Частицам дисперсной фазы таких систем не свойственно броуновское движение, поскольку, чем крупнее частица, тем больше столкновений с молекулами дисперсионной среды она испытывает в единицу времени и тем больше вероятность того, что импульсы будут взаимно скомпенсированы.
Коллоидно-дисперсные системы являются седиментационно устойчивыми, так как частицы их дисперсных фаз принимают участие в броуновском движении (вероятность взаимной компенсации импульсов при столкновениях молекул с мелкой частицей уменьшается). Однако коллоидно-дисперсные системы являются агрегативно неустойчивыми. Это связано с большой удельной поверхностью дисперсной фазы и, как следствие, большим избытком энергии Гиббса на границах раздела фаз.
Потеря коллоидно-дисперсной системой агрегативной устойчивости называется коагуляцией.
До тех пор, пока процессы агрегации не приводят к нарушению седиментационной устойчивости ( частицы становятся крупнее, но по размерам не выходят за границу коллоидно-дисперсного состояния), внешне коагуляция может проявляться только в изменении цвета золя. По мере укрупнения частиц система начинает постепенно терять и седиментационную устойчивость — появляется помутнение, а затем выпадает осадок.
Особенно золи чувствительны к добавлению электролитов, которые уменьшают заряд коллоидных частиц за счет сжатия диффузного слоя. Другими словами, электролиты значительно ослабляют действие стабилизирующего фактора: снижение электрического заряда на частицах уменьшает электростатическое отталкивание одноименно заряженных частиц, которые легче агрегируют.
Электролитная коагуляция золей проявляется только при достижении некоторой критической концентрации ионов в золе Сп.к, называемой порогом коагуляции. Величину, обратную порогу коагуляции, называют коагулирующей способностью, или коагулирующим действием (γ).
Правило Шульце–Гарди. Коагулирующее действие электролитов на коллоидные растворы
с ионным стабилизатором подчиняется правилу Шульце-Гарди:
Коагуляцию коллоидных растоворов вызывают любые ионы, которые имеют знак заряда, противоположный заряду гранул. Коагулирующее действие ионов ( γ ) тем сильнее, чем выше заряд иона- коагулятора.
Отношение показателей коагулирующей способности одно-, двух- и трехзарядных ионов составляет приблизительно 1 : 60 : 700, т.е. пропорционально шестой степени заряда иона, имеющего противоположный знак заряда по сравнению с коллоидной частицей. С ростом коагулирующей способности иона-коагулятора уменьшается порог коагуляции: γ = 1/ Спк
Порог коагуляции рассчитывают по формуле:
С п.к
=![]()
где V0 — объем золя, л; Vmin— минимальный объем раствора электролита, вызывающий коагуляцию золя, л; С — концентрация электролита в растворе, моль/л.
Процесс дезагрегации частиц, обратный процессу коагуляции, называют пептизацией. В системе возможно установление равновесия между процессами агрегирования и дезагрегирования частиц фазы; этому состоянию соответствует определенная концентрация частиц в свободнодисперсной системе, равновесная по отношению к осадку.
Пептизация тем более вероятна, чем меньше времени прошло с момента коагуляции. Это объясняется тем, что коагулят (осадок) «стареет», коагуляционные контакты в нем постепенно переходят в конденсационные, частицы фазы срастаются и коагуляция принимает необратимый характер.
Пептизацию можно вызвать отмыванием коагулята водой от электролита, вызвавшего коагуляцию золя, — концентрация электролита при этом снижается и становится меньше порога коагуляции. Чаще всего пептизацию вызывают добавлением веществ, которые способны восстановить утраченный заряд коллоидных частиц. Пептизаторами могут быть ионы, способные к адсорбции на поверхности агрегатов по правилу избирательной адсорбции Панета— Фаянса (адсорбционная пептизация), или вещества, реагирующие с частью коагулята с образованием таких ионов. В последнем случае пептизацию называют диссолюционной, или химической.
Например, при пептизации осадка гидроксида железа(Ш) раствором хлорида железа(Ш) происходит адсорбция ионов Fе3+ на частицах осадка, мицелла имеет следующее строение:
{m [Fе(ОН)3] n Fе3+3(n- х)С1-}3х+ЗхС1-
В данном случае реализуется механизм адсорбционной пептизации.
Примером диссолюционной (химической) пептизации является пептизация осадка гидроксида железа(Ш) соляной кислотой. Происходит химическая реакция НСl с частью осадкa:
Fe (ОН)3 + Н+ → Fe (ОН)2+ + Н20
Fe (ОН)2+ + FеО+ + Н20
а затем адсорбция ионов пептизатора на частицах осадка. Строение мицеллы полученного золя описывает формула
{m [Fе(ОН)3]n FеО+(n- х)С1-}х+хС1-
Пептизацию можно проводить также растворами ПАВ. Молекулы ПАВ, адсорбируясь на частицах осадка, повышают сродство дисперсной фазы к дисперсионной среде в соответствии с правилом выравнивания полярностей Ребиндера, т.е. повышают в некоторой степени лиофильность лиофобного золя.
Ускорить процесс пептизации можно повышением температуры и перемешиванием.
