
- •400066, Волгоград, пл. Павших Борцов, 1
- •Правила по технике безопасности при работе в химической лаборатории
- •Глава 1. Номенклатура и изомерия органических соединений.
- •§ 1.1. Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •§ 1.2. Основы строения и реакционной способности оргаических соединений
- •§ 1.2.1. Общая характеристика органических соединений
- •§ 1.2.2. Классификация органических соединений
- •§ 1.2.3. Номенклатура.
- •§ 1.2.3.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •§ 1.2.3.2. Радикально-функциональная номенклатура
- •Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
- •§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
- •Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
- •§ 2.1. Пространственное строение органических соединений. Стереоизомерия
- •§ 2.2. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Электронные эффекты заместителей
- •§ 2.3. Системы с замкнутой цепью сопряжения.
- •§ 2.4. Гетероциклические ароматические соединения.
- •§ 2.5. Кислотно-основные свойства органических соединений. Типы кислот и оснований. Определение понятий «кислота» и «основание».
- •§ 2.5.1. Кислоты и основания по Бренстеду
- •Значение рКа некоторых кислот Бренстеда
- •Основания Бренcтеда.
- •Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
- •§ 2.5.2. Льюисовская кислотность и основность органических соединений.
- •§ 2.5.3. Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Классификация кислот и оснований по Пирсону
- •Глава 3. Механизмы реакций органических соединений.
- •§ 3.1. Классификация органических реакций и их компонентов.
- •§ 3.2. Основные типы органических реакций
- •§ 3.3. Механизмы реакций в органической химии
- •§ 3.3.1. Реакции радикального замещения - sr
- •§ 3.3.2. Реакции нуклеофилъного замещения у тетрагонального атома углерода (sn)
- •§ 3.3.3. Реакции элиминирования ( е1 и е2).
- •§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
- •§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •§ 4.1. Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •§4.2. Химические свойства альдегидов и кетонов.
- •§ 4.3. Альдегиды и их производные
- •§ 4.3. Лабораторный практикум.
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
- •§ 5.2. Химические свойства предельных кислот и их производных
- •§ 5.3. Кислотно-основные свойства.
- •§ 5.4. Карбоновые кислоты как ацилирующие реагенты
- •Реакции декарбоксилирования
- •§ 5.5. Производные карбоновых кислот, их свойства и взаимные превращеия
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •§ 5.6. Отдельные представители амидов кислот.
- •§ 5. 7. Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •§ 5.8. Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •§ 5.9. Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Биологически активные гетерофункциональные соединения.
- •§ 6.1. Классификация поли- и гетерофункциональных соединений
- •§ 6.2. Общая характеристика реакционной способности
- •Специфические реакции.
- •§ 6.3. Аминоспирты
- •§ 6.4. Гидроксикарбоновые кислоты
- •§ 6.5. Оксокарбоновые кислоты
- •§ 6.6. Фенолокислоты. Особенности строения, свойства и биологическая роль.
- •Отдельные представители фенолокислот.
- •§ 6.7. Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически активные гетероциклические соединения.
- •§ 7.1. Понятие о гетероциклических соединениях
- •§ 7.1.1. Пятичленные гетероциклы.
- •§ 7.1.2. Шестичленные гетероциклы.
- •§ 7.1.3. Бициклические гетероциклы.
- •§7.2. Лабораторный практикум.
- •Ход работы.
- •Глава 8. Аминокислоты, пептиды, белки
- •§ 8.1.Строение и свойства аминокислот.
- •§ 8.2. Пептиды.
- •§ 8.3. Качественные реакции на аминокислоты и белки.
- •§ 8.4. Физиологическая роль и применение в медицине некоторых аминокислот
- •§ 8.5. Белки
- •1. Каталитическая функция
- •7. Защитная функция
- •§ 8.6. Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •§ 9.1. Строение и свойства углеводов.
- •§ 9.1. 1. Классификация углеводов.
- •§9.1.2. Изомерия моносахаров.
- •§9.1.3. Химические свойства моносахаридов.
- •§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара)
- •§ 9.3. Олиго- и полисахариды.
- •§ 9.3.1. Полисахариды.
- •§ 9.4. Гетерополисахариды
- •§ 9.5. Функции углеводов и их обмен
- •§ 9.6. Роль углеводов в развитии кариеса зубов
- •Контрольные вопросы
- •§ 9.7. Лабораторная работа «Свойства простых и сложных углеводов»
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •§ 10.1. Нуклеиновые основания, нуклеозиды, нуклеотиды.
- •§ 10.2. Нуклеотидный состав и структура днк и рнк.
- •§10.3. Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •§ 10.4. Лабораторная работа. «Гидролиз нуклеиновых кислот»
- •Глава 11. Омыляемые и неомыляемые липиды.
- •§ 11.1. Липиды. Строение и классификация липидов
- •§ 11.2. Простые липиды
- •§ 11.2.1. Жиры
- •Константы некоторых жиров животного и растительного происхождения
- •§ 11.2.2. Воски
- •§ 11.2.3. Стериды. Стероиды и стероидные гормоны.
- •§11.2.4.Желчные килоты
- •Стероидные гормоны
- •§ 11.3. Сложные липиды
- •§ 11.4. Лабораторный практикум «Омыляемые и неомыляемые липиды. Терпеноиды и стероиды»
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •§ 12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •§ 12.2. Поверхностная активность веществ.
- •§ 12.3. Адсорбция.
- •2. Изотерма Ленгмюра:
- •§12.4. Лабораторный практикум «Адсорбция поверхностно-активного вещества на границе раздела жидкость-воздух или жидкость-жидкость».
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •§ 13.1. Адсорбция на границе твердое тело — раствор. Влияние различных факторов на величину адсорбции.
- •§ 13.1.1. Молекулярная адсорбция.
- •§13.1.2. Адсорбция сильных электролитов.
- •§13.2. Адгезия и когезия.
- •Задание для самостоятельной подготовки
- •Контрольные вопросы
- •§13.3. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •§ 14.1. Дисперсные системы и их классификация.
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •§ 14.2. Получение и устойчивость дисперсных систем
- •§ 14.3. Строение мицелл.
- •§ 14.4. Слюна как дисперсная система.
- •§ 14.5. Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
§ 8.5. Белки
(Самостоятельная работа студентов).
Белки представляют собой соединения, в полипептидных цепях которых содержатся более 50 аминокислотных остатков. Они делятся на белки, состоящие только из остатков аминокислот (простые белки, или протеины) и на белки, в состав которых помимо аминокислот входят остатки соединений, относящихся к другим классам (сложные белки, или протеиды).
Небелковую (т. е. не аминокислотную) часть молекулы называют простетической группой; она определяет классификацию белков на группы:
гликопротеины — аминокислоты + углеводы;
липопротеины — аминокислоты + липиды;
нуклеопротеины — аминокислоты + нуклеотиды;
фосфопротеины — аминокислоты + фосфорная кислота;
металлопротеины — аминокислоты + ионы металлов.
Если сложный белок является ферментом, то его простетическая (небелковая) группа нередко является коферментом, т. е. соединением, необходимым для проявления каталитической активности фермента. Протеиновую (белковую) часть фермента в этом случае называют апоферментом. Отнесение белка к тому или иному классу делают на основе его первичной структуры.
Строение белков. Вторичная структура белков (как и пептидов) отражает расположение полипептидной цепи в пространстве. Характер пространственной структуры полипептидной цепи обусловлен дополнительным образованием пяти типов связей между отдельными аминокислотными остатками, стабилизирующих структуру белковой молекулы:
1) дисульфидные мостики;
2) водородные связи;
3) ионные связи;
4) гидрофобные связи;
5) гидратируемые группы.
При этом связываемые остатки могут находиться и на достаточно удаленных друг от друга участках полипептидной цепи.
Рассмотрим основные типы связей, реализующихся в белковых молекулах.
1.Дисульфидные мостики образуются между остатками цистеина за счет окисления тиольных групп в дисульфидные:
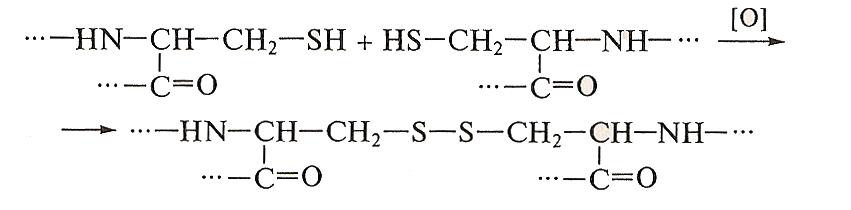
Мостики возникают как между остатками цистеина, расположенными в одной цепи (как, например, в окситоцине или вазопрессине), так и между остатками, находящимися в разных цепях, если белок состоит из более чем одной полипептидной единицы, как в инсулине (рис. 12) или иммуноглобулинах.
2. Водородные связи также являются ключевыми при формировании вторичной структуры белка, так как образование каждой водородной связи стабилизирует молекулу. Геометрия пептидной связи позволяет существование полипептидной цепи в нескольких видах:
а) «сложенный лист»;
б) α-спираль;
в) неупорядоченная структура.
Водородные связи могут образовываться между карбонильной группой одной пептидной связи и группой NH другой связи. Причем связываемые группировки могут находиться как в одной и той же цепи, так и в разных цепях:

Рис. 12 Фрагмент молекулы инсулина быка.

α-Спираль возникает за счет внутрицепочечных водородных связей, когда группы N—Н и С=0 находятся на разных участках одной и той же полипептидной цепи. Такой тип водородных связей возможен только в том случае, если основная цепь сворачивается в спираль с шагом в 3,6 аминокислотных остатка. Только при таком взаимном расположении групп N—Н и С=0, принадлежащих разным пептидным связям, виток спирали фиксируется водородной связью. Спиралевидная структура обеспечивает более энергетически выгодное расположение боковых групп друг относительно друга, что особенно существенно для аминокислотных остатков с объемными заместителями при α-углеродном атоме.
Неупорядоченная структура характерна только для отдельных фрагментов цепи, которые чаще всего появляются между спирализованными и складчатыми участками в ходе формирования третичной структуры белка.
3. Ионные связи являются результатом электростатического взаимодействия и появляются в тех случаях, когда в боковой цепи имеются заряженные группы — катионы NH4+ (протонированные аминогруппы лизина, гуанидиновые группировки аргинина, основные атомы азота имидазольного кольца гастидина) и анионы СОО" (карбоксилат-анионы аспарагиновой и глутаминовой кислот). Возможно и электростатическое взаимодействие N- и С-концов полипептидной цепи.
4. Гидрофобные связи (гидрофобные взаимодействия) представляют собой результат несвязного взаимодействия неполярных алкильных групп боковых цепей таких аминокислот, как аланин, валин, лейцин, изолейцин за счет сил Ван-дер-Ваальса.
5. Гидратируемые группы оказывают влияние на формирование вторичной структуры белка, тогда когда молекулы воды, окружающие белковую молекулу, могут образовывать структуру, подобную структуре льда.
Очень важно, что из всех перечисленных вариантов внутри- и межмолекулярных взаимодействий только дисульфидные мостики не зависят от показателя рН среды, полярности растворителя и ионной силы раствора. Дисульфидные мостики разрушаются только под действием восстановителей.
Организованная определенным образом во вторичную структуру молекула белка затем укладывается в компактную плотную структуру, называемую третичной структурой белка. В ее образовании участвуют как регулярные (спирализованные или β-складчатые), так и аморфные участки полипептидной цепи.
В некоторой степени третичная структура белков отражена в системе классификации белков, основанной на их растворимости в водных средах. В этом варианте классификации различают глобулярные белки, растворимые в воде и водных растворах кислот, оснований и солей, и фибриллярные белки, не растворимые в этих растворителях.
Третичная структура фибриллярных белков характеризуется нитевидностью (лат. fibrilla — волоконце). Длина молекул этих белков в сотни раз больше их диаметра, что обусловлено параллельной (или антипараллельной) ориентацией их цепей. Цепи фибриллярных белков группируются друг около друга в виде протяженных пучков и отличаются очень большим числом межцепочечных водородных связей. Такие молекулы не растворимы в воде, так как растворение требует высоких энергетических затрат на разрыв водородных связей, и очень прочны, поэтому они являются основным строительным материалом живых тканей (например, кератины, коллаген, эластин, миозин, фиброин и пр.).
Третичная структура глобулярных белков имеет вид компактных клубочков (лат. globulus — шарик). В глобулярных белках преобладают внутримолекулярные водородные связи; число межмолекулярных связей невелико. Все или почти все полярные группы глобулярных белков расположены на поверхности молекул; гидрофобные остатки находятся внутри свернутой цепи. Гидратация молекул энергетически выгодна из-за доступности полярных групп и немногочисленности межмолекулярных водородных связей, что и обеспечивает высокую растворимость глобулярных белков. В организме глобулярные белки выполняют роль регуляторов и стабилизаторов процессов жизнедеятельности; к ним относятся ферменты, гормоны, глобулины, альбумины, тканевые белки и т.д.
У ряда белковых соединений несколько сложных полипептидных цепей могут агрегироваться вместе, создавая более сложный комплекс определенного строения, называемый четвертичной структурой белка. Каждую полипептидную цепь, образующую четвертичную структуру, называют субъединицей. Она сохраняет свойственные ей первичную, вторичную и третичную структуры, однако биологическая роль комплекса в целом отличается от биологической роли субъединиц вне комплекса. Фиксация четвертичной структуры обеспечивается водородными связями и гидрофобными взаимодействиями между субъединицами. Например, молекула гемоглобина — белка с четвертичной структурой — состоит из четырех субъединиц, окружающих гем (простетическую железосодержащую группу — железопорфирин); между субъединицами нет ковалентной связи, однако тетрамер представляет собой единое целое, в котором субъединицы прочно связаны и ведут себя в растворе как одна молекула. Наличие четвертичной структуры характерно также для других металлопротеинов и для иммуноглобулинов. При формировании четвертичной структуры белка образующийся комплекс может содержать помимо субъединиц полипептидной структуры и субъединицы иной полимерной природы, а также соединения других классов.
Изменение условий, в которых находится молекула белка: варьирование рН среды, повышение температуры, облучение УФ-светом, рентгеновскими лучами, сильное механическое воздействие, давление, ультразвук — приводят к разрушению связей, обеспечивающих сохранение четвертичной, третичной и даже вторичной структуры, и, следовательно, к разрушению уникальной нативной (созданной природой) структуры белка. Этот процесс носит название денатурации белка. Нарушение нативной конформации белка может быть обратимым (если изменение структуры легко устранимо и нативная структура восстанавливается) и необратимым (особенно выражено при повышении температуры, лучевом воздействии, обработке сильными кислотами и щелочами). Денатурация белка сопровождается снижением гидрофильности белковых молекул, уменьшением стабильности растворов белка в изоэлектрической точке, повышением реакционной способности функциональных групп молекулы. Большинство белковых молекул проявляют специфическую функциональную активность только в узком интервале значений рН и температуры (физиологические значения). В результате изменений указанных параметров белок теряет активность из-за денатурации. Денатурированные белки существуют в виде случайных хаотических петель и клубков, форма которых подвержена изменениям.
Поверхностные свойства белков. Белки являются поверхностно-активными веществами, что связано с наличием в молекуле фрагментов с различными гидрофильно-гидрофобными свойствами. Поверхностную активность белки проявляют прежде всего за счет боковых цепей. Таким образом, белки являются стабилизаторами лиофобных дисперсных систем — эмульгаторами жиров и холестерина; осуществляют транспорт жиров из кишечника в ткани.
Каждый белок имеет свойственные только ему последовательность аминокислотных остатков, пространственную структуру и функции.
Функции белков в организме разнообразны.
