
- •400066, Волгоград, пл. Павших Борцов, 1
- •Правила по технике безопасности при работе в химической лаборатории
- •Глава 1. Номенклатура и изомерия органических соединений.
- •§ 1.1. Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •§ 1.2. Основы строения и реакционной способности оргаических соединений
- •§ 1.2.1. Общая характеристика органических соединений
- •§ 1.2.2. Классификация органических соединений
- •§ 1.2.3. Номенклатура.
- •§ 1.2.3.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •§ 1.2.3.2. Радикально-функциональная номенклатура
- •Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
- •§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
- •Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
- •§ 2.1. Пространственное строение органических соединений. Стереоизомерия
- •§ 2.2. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Электронные эффекты заместителей
- •§ 2.3. Системы с замкнутой цепью сопряжения.
- •§ 2.4. Гетероциклические ароматические соединения.
- •§ 2.5. Кислотно-основные свойства органических соединений. Типы кислот и оснований. Определение понятий «кислота» и «основание».
- •§ 2.5.1. Кислоты и основания по Бренстеду
- •Значение рКа некоторых кислот Бренстеда
- •Основания Бренcтеда.
- •Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
- •§ 2.5.2. Льюисовская кислотность и основность органических соединений.
- •§ 2.5.3. Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Классификация кислот и оснований по Пирсону
- •Глава 3. Механизмы реакций органических соединений.
- •§ 3.1. Классификация органических реакций и их компонентов.
- •§ 3.2. Основные типы органических реакций
- •§ 3.3. Механизмы реакций в органической химии
- •§ 3.3.1. Реакции радикального замещения - sr
- •§ 3.3.2. Реакции нуклеофилъного замещения у тетрагонального атома углерода (sn)
- •§ 3.3.3. Реакции элиминирования ( е1 и е2).
- •§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
- •§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •§ 4.1. Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •§4.2. Химические свойства альдегидов и кетонов.
- •§ 4.3. Альдегиды и их производные
- •§ 4.3. Лабораторный практикум.
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
- •§ 5.2. Химические свойства предельных кислот и их производных
- •§ 5.3. Кислотно-основные свойства.
- •§ 5.4. Карбоновые кислоты как ацилирующие реагенты
- •Реакции декарбоксилирования
- •§ 5.5. Производные карбоновых кислот, их свойства и взаимные превращеия
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •§ 5.6. Отдельные представители амидов кислот.
- •§ 5. 7. Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •§ 5.8. Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •§ 5.9. Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Биологически активные гетерофункциональные соединения.
- •§ 6.1. Классификация поли- и гетерофункциональных соединений
- •§ 6.2. Общая характеристика реакционной способности
- •Специфические реакции.
- •§ 6.3. Аминоспирты
- •§ 6.4. Гидроксикарбоновые кислоты
- •§ 6.5. Оксокарбоновые кислоты
- •§ 6.6. Фенолокислоты. Особенности строения, свойства и биологическая роль.
- •Отдельные представители фенолокислот.
- •§ 6.7. Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически активные гетероциклические соединения.
- •§ 7.1. Понятие о гетероциклических соединениях
- •§ 7.1.1. Пятичленные гетероциклы.
- •§ 7.1.2. Шестичленные гетероциклы.
- •§ 7.1.3. Бициклические гетероциклы.
- •§7.2. Лабораторный практикум.
- •Ход работы.
- •Глава 8. Аминокислоты, пептиды, белки
- •§ 8.1.Строение и свойства аминокислот.
- •§ 8.2. Пептиды.
- •§ 8.3. Качественные реакции на аминокислоты и белки.
- •§ 8.4. Физиологическая роль и применение в медицине некоторых аминокислот
- •§ 8.5. Белки
- •1. Каталитическая функция
- •7. Защитная функция
- •§ 8.6. Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •§ 9.1. Строение и свойства углеводов.
- •§ 9.1. 1. Классификация углеводов.
- •§9.1.2. Изомерия моносахаров.
- •§9.1.3. Химические свойства моносахаридов.
- •§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара)
- •§ 9.3. Олиго- и полисахариды.
- •§ 9.3.1. Полисахариды.
- •§ 9.4. Гетерополисахариды
- •§ 9.5. Функции углеводов и их обмен
- •§ 9.6. Роль углеводов в развитии кариеса зубов
- •Контрольные вопросы
- •§ 9.7. Лабораторная работа «Свойства простых и сложных углеводов»
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •§ 10.1. Нуклеиновые основания, нуклеозиды, нуклеотиды.
- •§ 10.2. Нуклеотидный состав и структура днк и рнк.
- •§10.3. Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •§ 10.4. Лабораторная работа. «Гидролиз нуклеиновых кислот»
- •Глава 11. Омыляемые и неомыляемые липиды.
- •§ 11.1. Липиды. Строение и классификация липидов
- •§ 11.2. Простые липиды
- •§ 11.2.1. Жиры
- •Константы некоторых жиров животного и растительного происхождения
- •§ 11.2.2. Воски
- •§ 11.2.3. Стериды. Стероиды и стероидные гормоны.
- •§11.2.4.Желчные килоты
- •Стероидные гормоны
- •§ 11.3. Сложные липиды
- •§ 11.4. Лабораторный практикум «Омыляемые и неомыляемые липиды. Терпеноиды и стероиды»
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •§ 12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •§ 12.2. Поверхностная активность веществ.
- •§ 12.3. Адсорбция.
- •2. Изотерма Ленгмюра:
- •§12.4. Лабораторный практикум «Адсорбция поверхностно-активного вещества на границе раздела жидкость-воздух или жидкость-жидкость».
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •§ 13.1. Адсорбция на границе твердое тело — раствор. Влияние различных факторов на величину адсорбции.
- •§ 13.1.1. Молекулярная адсорбция.
- •§13.1.2. Адсорбция сильных электролитов.
- •§13.2. Адгезия и когезия.
- •Задание для самостоятельной подготовки
- •Контрольные вопросы
- •§13.3. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •§ 14.1. Дисперсные системы и их классификация.
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •§ 14.2. Получение и устойчивость дисперсных систем
- •§ 14.3. Строение мицелл.
- •§ 14.4. Слюна как дисперсная система.
- •§ 14.5. Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
Вопросы к занятию.
-
Понятие об оптической изомерии органических соединений.
-
Асимметрические атомы углерода. Хиральные молекулы.
-
Относительная и абсолютная конфигурация молекул. Проекции Фишера.
-
Индуктивный электронный эффект.
-
Мезомерный электронный эффект. Сопряженные системы.
-
Понятие об ароматичности (бензол и небензоидные системы).
-
Электронно-донорные и электронно-акцепторные заместители в ароматическом кольце.
-
Кислотность и основность органических молекул.
-
Понятие о С-Н, О-Н, S-H, N-H кислотах.
-
Влияние электронных эффектов на кислотность и основность.
§ 2.1. Пространственное строение органических соединений. Стереоизомерия
Пространственная изомерия в молекуле обусловлена различным пространственным расположением атомов при одинаковом порядке их связывания.
Стереоизомеры - изомеры, имеющие одинаковую последовательность химических связей атомов, но различное расположение этих атомов относительно друг друга в пространстве.
Стереоизомеры могут различаться конформацией и конфигурацией.
Конформациями молекулы называются различные ее пространственные формы, возникающие в результате вращения атомов или групп вокруг ординарных связей.
Стереоизомеры, различие между которыми обусловлено поворотом отдельных участков молекулы вокруг ординарных связей, называются конформерами. Наиболее стабильными и энергетически выгодными конформерами являются те, в которых между несвязанными атомами или их группами межатомное отталкивание наименьшее; их называют заторможенными конформерами. Конформеры, где атомы или их группы расположены близко друг к другу, являются нестабильными и называются заслоненными. Переходной формой между заторможенной и заслоненной конформациями является скошенная конформация. Фактически различные конформеры находятся в динамическом равновесии, и возможность перехода одного конформера в другой определяется энергетическим барьером вращения, который составляет 10-50 кДж/моль. Поскольку энергетический барьер вращения невелик, то переход из одной конформации в другую осуществляется легко, и поэтому выделить конформеры в качестве устойчивых изомеров нельзя. Внутреннее вращение вокруг простых связей ограничивается или даже затормаживается в случае высокого энергетического барьера вращения.
Для
изображения результатов вращения по
связи С—С удобно
пользоваться проекционными формулами
Ньюмена (1955). Эти
проекции получают, рассматривая молекулу
вдоль С—С связи, вокруг
которой происходит вращение. Ближайший
к наблюдателю
атом углерода обозначается точкой
пересечения его связей
![]() ,
а удаленный от наблюдателя атом углерода
и его связи - окружностью
с линиями
,
а удаленный от наблюдателя атом углерода
и его связи - окружностью
с линиями
![]() .
На рис. 2 при помощи проекций Ньюмена
и стереохимических формул изображено
вращение
метильных групп вокруг связи С—С в
молекуле этана.
.
На рис. 2 при помощи проекций Ньюмена
и стереохимических формул изображено
вращение
метильных групп вокруг связи С—С в
молекуле этана.

В длинных углеродных цепях вращение возможно вокруг нескольких С—С связей. Поэтому вся цепь может принимать разнообразные геометрические формы, среди которых зигзагообразная конформация наиболее устойчива. Именно эта конформация характерна для гидрофобных фрагментов природных жирных кислот и их производных.
В циклических соединениях вращение вокруг ординарных связей ограничено, что приводит к возникновению определенных конформаций. В природных соединениях особенно часто встречается фрагмент, содержащий циклогексановый цикл. Атомы углерода в этом цикле находятся в состоянии sр3-гибридизации, и, следовательно, их химические связи не лежат в одной плоскости. У циклогексана возникают два конформера типа кресла и ванны (рис. 3).
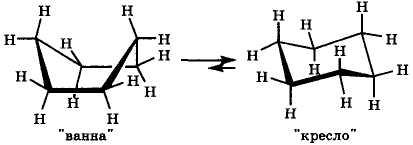
Рис. 3. Циклогексан в конформациях ванны и кресла
В конформации «кресло», в отличие от конформации «ванна», не имеется заслоненных положений атомов водорода, поэтому она термодинамически более устойчива. При комнатной температуре молекулы циклогексана существуют практически только в конформации кресла.
Производные циклогексана, содержащие два и более объемных заместителя, имеют такую конформацию, в которой эти заместители располагаются наиболее удаленно друг от друга, например по разные стороны от плоскости цикла.
Биологическое действие многих лекарственных веществ и биорегуляторов (гормоны, витамины, антибиотики и др.) тесно связано с пространственным строением их молекул. Для наиболее полного связывания этих веществ рецепторами клетки они должны иметь определенную конформацию. Изменение конформаций, как правило, снижает степень связывания и ослабляет биологическое действие. О конформации белков, полисахаридов и нуклеиновых кислот речь пойдет в соответствующих разделах.
Стереоизомеры могут отличаться не только конформацией, но и конфигурацией.
Конфигурациями молекул называются разные пространственные расположения атомов или групп, которые не могут быть переведены друг в друга простым вращением вокруг связей.
В отличие от конформационных изомеров, которые легко превращаются друг в друга, конфигурационные изомеры устойчивы. Различают два вида конфигурационной изомерии: геометрическую, или цис-транс-изомерию, и оптическую изомерию.
Геометрическая изомерия. Стереоизомеры, отличающиеся друг от друга расположением заместителей по отношению к плоскости двойной связи или цикла, называются геометрическими изомерами. Изомер, содержащий одинаковые заместители по одну сторону от плоскости связи (цикла), называется цис-изомером, а если они расположены с противоположных сторон — транс-изомером:
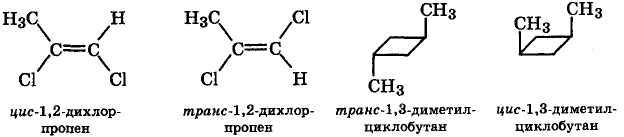
Цис-транс-изомеры отличаются друг от друга не только физическими и химическими свойствами, но и биологической активностью, что определяет различное их участие в физиологических процессах биосистем.

Оптическая изомерия. Она характерна для несимметричных соединений, у которых в молекуле имеется атом углерода в состоянии sрЗ-гибридизации, связанный с четырьмя различными атомами или группами. Такой атом углерода называется асимметрическим и обозначается С*. Оптические изомеры отличаются друг от друга как несимметричный предмет от своего изображения в зеркале, и их нельзя перевести друг в друга путем внутреннего вращения (рис. 4). Другими словами, изомеры L и D относятся друг к другу как левая рука к правой и они несовместимы. Это свойство называется хиралъностью (от греч. χειρος – рука), а асимметрический атом - хиральным центром. В большинстве случаев наличие хирального атома в молекуле уже служит указанием на ее хиральность.

Рис. 4. Хиральные объекты
Наиболее важным следствием хиральности молекул является существование их в виде пары пространственных изомеров – энантиомеров , представляющих нсовместимые в пространстве зеркальные изображения (зеркальные антиподы).
Энантиомеры – стереоизомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение.
У оптических изомеров физические и химические свойства идентичны (они имеют одинаковые температуры плавления и кипения, обладают одинаковой растворимостью и т.д.), но по отношению к плоскополяризованному свету они ведут себя по-разному. Один из изомеров называется левовращающим, так как он поворачивает плоскость поляризации света на определенный угол влево (т. е. против часовой стрелки) и обозначается (-), а другой изомер — вправо на такой же угол и называется правовращающим (+). Измерение оптической активности соединений производится на поляриметре при облучении монохроматическим светом с длиной волны λ= 589 нм при 20о С. Общая схема устройства поляриметра и принцип его действия показаны на рис.4а.

Оптические изомеры называют также оптическими антиподами или энантиомерами. Эквимолярная смесь энантиомеров называется рацематом. Рацематы оптически неактивны. Таким образом, энантиомеры одного и того же вещества не могут непосредственно перейти друг в друга, и поэтому оптическая изомерия не может иметь равновесный характер.
Относительная и абсолютная конфигурации.
Определение абсолютной конфигурации, т.е. истинного расположения в пространстве заместителей у хирального центра, стало возможным только с появлением высокоразрешающих физико-химических методов, в частности рентгеноструктурного анализа. Первым соединенем, для которого в 1951 году удалось определить абсолютную конфигурацию, была (+) –винная кислота.
Установление абсолютной конфигурации – трудоемкий процесс. После выснения абсолютных конфигураций нескольких соединений появилась возможность характеризовать все остальные путем сравнения их конфигураций с конфигурациями эталонных (ключевых ) соединений, т.е. определять относительные конфигурации. По предложению М.А. Розанова в 1906 году (еще задолго до появления реальной возможности установления абсолютной конфигурации) за конфигурационный стандарт был принят глицериновый альдегид. Его право- и левовращающим энантиомерам были приписаны определенные конфигурации, обозначенные как D(+) и L(–) – глицериновые альдегиды.

D(+)– глицериновый альдегид L(–) – глицериновый альдегид
Правильность произвольно приписанной (+) – глицериновому альдегиду конфигурации в дальнейшем была подтверждена экспериментально и проибрела силу абсолютной конфигурации, а буквы D и L стали символами стереохимической номенклатуры.
Хиральность характерна для всех природных аминокислот, кроме глицина, поскольку их молекулы содержат асимметричный атом углерода, вокруг которого располагаются четыре различных заместителя (—R, —Н, — СОО-, —NН+3):

Оптические изомеры на примере α-аминокислоты
Оптические изомеры α-аминокислот в соответствии с их истинной конфигурацией обозначаются буквами L и D, а по новой системе — S и R соответственно. Природные α-аминокислоты в подавляющем большинстве относятся к L(S)-энантиомерам ле-вовращающим (-). Использование для построения белков в организме человека только L-энантиомеров имеет важнейшее значение для формирования пространственной структуры белков. С этим непосредственно связана стереоспецифичность действия ферментов. Молекулы ферментов хиральны и вступают во взаимодействие только с теми субстратами, которые также имеют определенную конфигурацию. Поэтому биологической активностью обычно обладает лишь один стереоизомер, а другие значительно менее активны или вообще неактивны.
Связь пространственного строения соединений с их биологической активностью. В организме реакции протекают с участием биокатализаторов – ферментов. Ферменты построены из хиральных молекул α-аминокислот. Поэтому они могут играть роль хиральных реагкнтов, чувствительных к хиральности взаимодействующих с ними субстратов. Таким образом, пространственное строение молекул связано со стереоспецифичностью биохимических процессов.
Стереспецифичность процессов, протекающих в организме, состоит в том, что в реакцию вовлекаются определенные стереизомеры и результатом реакции являются также стереохимически ориентированные продукты.
Стереоспецифичность лежит в основе проявления биологического действия одним из энантиомеров, в то время как другой энантиомер может быть неактивным, а иногда оказывать иное или даже противоположное действие.
Многие лекарственные вещества проявляют фармакологический эффект при взаимодействии с рецепторами клетки. Для этого необходимо, чтобы молекула лекарственного вещества имела такую конфигурацию, которая позволяла бы наиболее полно связываться с рецептором. Изменение конфигурации на противоположную, как правило, снижает степень связывания и ослабляет биологическое действие. Например, из двух энантиомеров адреналина наибольшую гормональную активность проявляет левовращающий адреналин, являющийся (R)-изомером (рис. 5, а). У правовращающего энантиомера — (S)-адреналина — ОН-группа ориентирована в пространстве иначе и не взаимодействует с рецептором (рис. 5, б). Этот энантиомер адреналина способен связываться не с тремя, а только с двумя точками рецептора, что приводит к ослаблению фармакологического действия. Это подтверждается тем фактом, что пониженная активность (+)-адреналина сравнима с активностью, проявляемой дезоксиадреналином, не содержащим ОН-группы.

Рис. 5. Схема взаимодействия энантиомеров адреналина с рецептором

адреналин изадрин

сарколизин
Таким образом, биологическое действие биорегуляторов (гормоны, витамины, антибиотики и др.) и лекарственных веществ связано с пространственным строением их молекул.
