
- •400066, Волгоград, пл. Павших Борцов, 1
- •Правила по технике безопасности при работе в химической лаборатории
- •Глава 1. Номенклатура и изомерия органических соединений.
- •§ 1.1. Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •§ 1.2. Основы строения и реакционной способности оргаических соединений
- •§ 1.2.1. Общая характеристика органических соединений
- •§ 1.2.2. Классификация органических соединений
- •§ 1.2.3. Номенклатура.
- •§ 1.2.3.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •§ 1.2.3.2. Радикально-функциональная номенклатура
- •Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
- •§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
- •Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
- •§ 2.1. Пространственное строение органических соединений. Стереоизомерия
- •§ 2.2. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Электронные эффекты заместителей
- •§ 2.3. Системы с замкнутой цепью сопряжения.
- •§ 2.4. Гетероциклические ароматические соединения.
- •§ 2.5. Кислотно-основные свойства органических соединений. Типы кислот и оснований. Определение понятий «кислота» и «основание».
- •§ 2.5.1. Кислоты и основания по Бренстеду
- •Значение рКа некоторых кислот Бренстеда
- •Основания Бренcтеда.
- •Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
- •§ 2.5.2. Льюисовская кислотность и основность органических соединений.
- •§ 2.5.3. Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Классификация кислот и оснований по Пирсону
- •Глава 3. Механизмы реакций органических соединений.
- •§ 3.1. Классификация органических реакций и их компонентов.
- •§ 3.2. Основные типы органических реакций
- •§ 3.3. Механизмы реакций в органической химии
- •§ 3.3.1. Реакции радикального замещения - sr
- •§ 3.3.2. Реакции нуклеофилъного замещения у тетрагонального атома углерода (sn)
- •§ 3.3.3. Реакции элиминирования ( е1 и е2).
- •§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
- •§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •§ 4.1. Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •§4.2. Химические свойства альдегидов и кетонов.
- •§ 4.3. Альдегиды и их производные
- •§ 4.3. Лабораторный практикум.
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
- •§ 5.2. Химические свойства предельных кислот и их производных
- •§ 5.3. Кислотно-основные свойства.
- •§ 5.4. Карбоновые кислоты как ацилирующие реагенты
- •Реакции декарбоксилирования
- •§ 5.5. Производные карбоновых кислот, их свойства и взаимные превращеия
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •§ 5.6. Отдельные представители амидов кислот.
- •§ 5. 7. Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •§ 5.8. Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •§ 5.9. Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Биологически активные гетерофункциональные соединения.
- •§ 6.1. Классификация поли- и гетерофункциональных соединений
- •§ 6.2. Общая характеристика реакционной способности
- •Специфические реакции.
- •§ 6.3. Аминоспирты
- •§ 6.4. Гидроксикарбоновые кислоты
- •§ 6.5. Оксокарбоновые кислоты
- •§ 6.6. Фенолокислоты. Особенности строения, свойства и биологическая роль.
- •Отдельные представители фенолокислот.
- •§ 6.7. Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически активные гетероциклические соединения.
- •§ 7.1. Понятие о гетероциклических соединениях
- •§ 7.1.1. Пятичленные гетероциклы.
- •§ 7.1.2. Шестичленные гетероциклы.
- •§ 7.1.3. Бициклические гетероциклы.
- •§7.2. Лабораторный практикум.
- •Ход работы.
- •Глава 8. Аминокислоты, пептиды, белки
- •§ 8.1.Строение и свойства аминокислот.
- •§ 8.2. Пептиды.
- •§ 8.3. Качественные реакции на аминокислоты и белки.
- •§ 8.4. Физиологическая роль и применение в медицине некоторых аминокислот
- •§ 8.5. Белки
- •1. Каталитическая функция
- •7. Защитная функция
- •§ 8.6. Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •§ 9.1. Строение и свойства углеводов.
- •§ 9.1. 1. Классификация углеводов.
- •§9.1.2. Изомерия моносахаров.
- •§9.1.3. Химические свойства моносахаридов.
- •§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара)
- •§ 9.3. Олиго- и полисахариды.
- •§ 9.3.1. Полисахариды.
- •§ 9.4. Гетерополисахариды
- •§ 9.5. Функции углеводов и их обмен
- •§ 9.6. Роль углеводов в развитии кариеса зубов
- •Контрольные вопросы
- •§ 9.7. Лабораторная работа «Свойства простых и сложных углеводов»
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •§ 10.1. Нуклеиновые основания, нуклеозиды, нуклеотиды.
- •§ 10.2. Нуклеотидный состав и структура днк и рнк.
- •§10.3. Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •§ 10.4. Лабораторная работа. «Гидролиз нуклеиновых кислот»
- •Глава 11. Омыляемые и неомыляемые липиды.
- •§ 11.1. Липиды. Строение и классификация липидов
- •§ 11.2. Простые липиды
- •§ 11.2.1. Жиры
- •Константы некоторых жиров животного и растительного происхождения
- •§ 11.2.2. Воски
- •§ 11.2.3. Стериды. Стероиды и стероидные гормоны.
- •§11.2.4.Желчные килоты
- •Стероидные гормоны
- •§ 11.3. Сложные липиды
- •§ 11.4. Лабораторный практикум «Омыляемые и неомыляемые липиды. Терпеноиды и стероиды»
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •§ 12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •§ 12.2. Поверхностная активность веществ.
- •§ 12.3. Адсорбция.
- •2. Изотерма Ленгмюра:
- •§12.4. Лабораторный практикум «Адсорбция поверхностно-активного вещества на границе раздела жидкость-воздух или жидкость-жидкость».
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •§ 13.1. Адсорбция на границе твердое тело — раствор. Влияние различных факторов на величину адсорбции.
- •§ 13.1.1. Молекулярная адсорбция.
- •§13.1.2. Адсорбция сильных электролитов.
- •§13.2. Адгезия и когезия.
- •Задание для самостоятельной подготовки
- •Контрольные вопросы
- •§13.3. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •§ 14.1. Дисперсные системы и их классификация.
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •§ 14.2. Получение и устойчивость дисперсных систем
- •§ 14.3. Строение мицелл.
- •§ 14.4. Слюна как дисперсная система.
- •§ 14.5. Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
§9.1.3. Химические свойства моносахаридов.
В химическом отношении монозы сочетают в себе свойства многоатомных спиртов, карбонильных соединений и полуацеталей.
1.Образование гликозидов. Для циклических форм моноз наиболее характерны реакции с участием гидроксильной группы. Наиболее химически активна полуацетальная гидроксильная группа.
Моносахариды взаимодействуют со спиртами с образованием О-гликозидов. Так, при пропускании через раствор β-D-глюкозы в этаноле газообразного хлороводорода происходит образование смеси α- и β-аномеров — этил-α,β-D-глюкопиранозы:

Молекула этанола выступает в данной реакции в роли нуклеофила. Аналогично монозы взаимодействуют с аминами и их производными с образованием N-гликозидов:

Гликозиды представляют собой продукты конденсации циклических форм моносахаридов со спиртами и аминами с образованием гликозидной связи. Гликозиды легко подвергаются гидролизу в кислой среде. По типу О-гликозидов образуются ди- и полисахариды, а по типу N-гликозидов— нуклеозиды — структурные компоненты нуклеиновых кислот. Гликозиды играют чрезвычайно важную роль в биохимических процессах, в частности в процессах дыхания и фотосинтеза. Важнейший из гликозидов — аденозинтрифосфат (АТФ), являющийся сложным эфиром фосфорной кислоты и аденозина — нуклеозида, являющегося продуктом конденсации аденина с рибозой. Фосфатные группы АТФ выполняют роль своеобразного энергетического депо; при их гидролизе выделяется энергия, необходимая клеткам для мышечного сокращения.
Образование сложных эфиров. При взаимодействии с кислотами и их ангидридами монозы образуют сложные эфиры. Так, при взаимодействии глюкозы с уксусным ангидридом образуется пентаацетилглюкоза. Биологически важный пример реакции данного типа — реакция фосфорилирования глюкозы — ферментативное взаимодействие глюкозы с аденозинтрифосфорной кислотой с образованием глюкозо-6-фосфата:
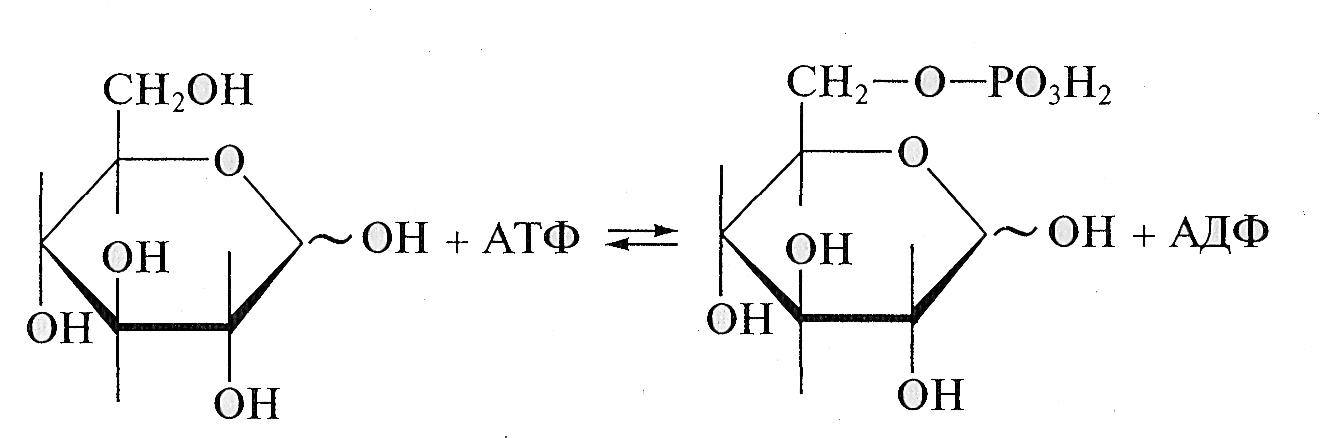
Реакция происходит на первой стадии гликолиза (процесса окисления глюкозы в пируват). Необходимо заметить, что все промежуточные продукты гликолиза представляют собой сложные эфиры моноз и фосфорной кислоты.
2. Окисление моноз в кислой и нейтральной среде приводит к образованию различных кислот. Окислению может подвергаться:
а) только карбонильная группа — «мягкое» окисление, например, бромной водой:
НО-СН2-(СНОН)n-СНО → НО-СН2-(СНОН)n— СООН
Гликоновые кислоты
б) карбонильная и первичная гидроксильная группы - «жесткое» окисление, например, раствором HNO3:
НО-СН2- (СНОН)n- СНО → НООС-СН2-(СНОН)n-СООН
Гликаровые кислоты
в) только первичная гидроксильная группа в мягких условиях при защите альдегидной группы:

Гликурониды при нагревании легко декарбоксилируются, что приводит к образованию моноз с меньшим числом атомов углерода. Так можно получить из D-гликуронида пентозу — D-ксилозу.
Окисление моноз в щелочной среде сопровождается деструкцией углеродного скелета. Реакции окисления характерны не только для альдоз, но и для кетоз (в отличие от кетонов), что объясняется явлением эпимеризации моноз (см. далее). Окислению могут подвергаться и некоторые дисахариды, называемые восстанавливающими. Существуя преимущественно в форме полуацеталей, они обладают потенциально свободной альдегидной группой (в оксо-форме).
Восстанавливающие моно- и дисахариды восстанавливают ионы меди(II), входящие в состав комплекса с винной кислотой (С4Н606; H2tart) — реактив Фелинга [Cu(tart)2]2- или в состав комплекса с лимонной кислотой (C6H807; H3cit) — реактив Бенедикта [Cu(cit)]-, до оксида меди(I) Cu2O, а также ионы серебра в реактиве Толленса [Ag(NH3)2]OH до свободного серебра. Реакции используют как качественные на наличие восстанавливающих сахаридов.
3. Восстановление углеводов. Моносахариды подвергаются химическому либо билогическому восстановлению.
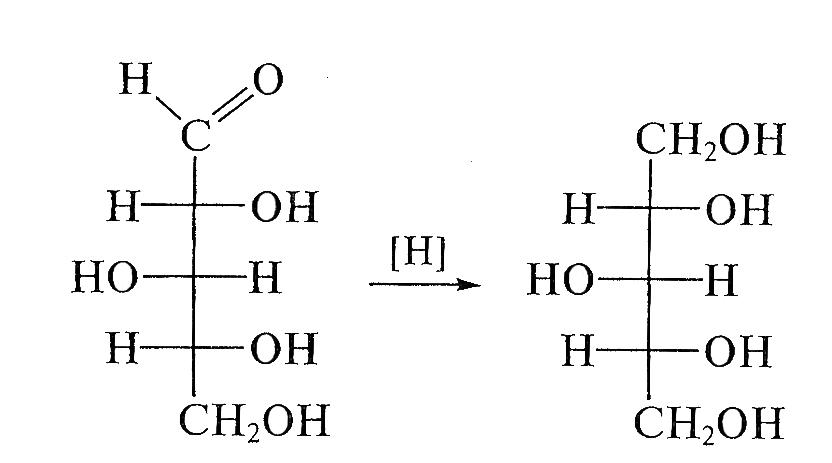
Восстановление моноз, как и всяких карбонильных соединений, приводит к превращению карбонильных групп в спиртовые; при этом образуются многоатомные спирты, называемые сахарными спиртами, или альдитами:
![]()
Помимо амальгамы натрия в водной (или вводно - спиртовой, или спиртовой) среде для восстановления моноз используют водород в присутствии катализаторов (Pt, Pd, Ni) и гидриды металлов (особенно NaBH4). Следует иметь в виду, что при восстановлении альдоз образуется один спирт, а при восстановлении кетоз получают два стеоизомерных полиола:
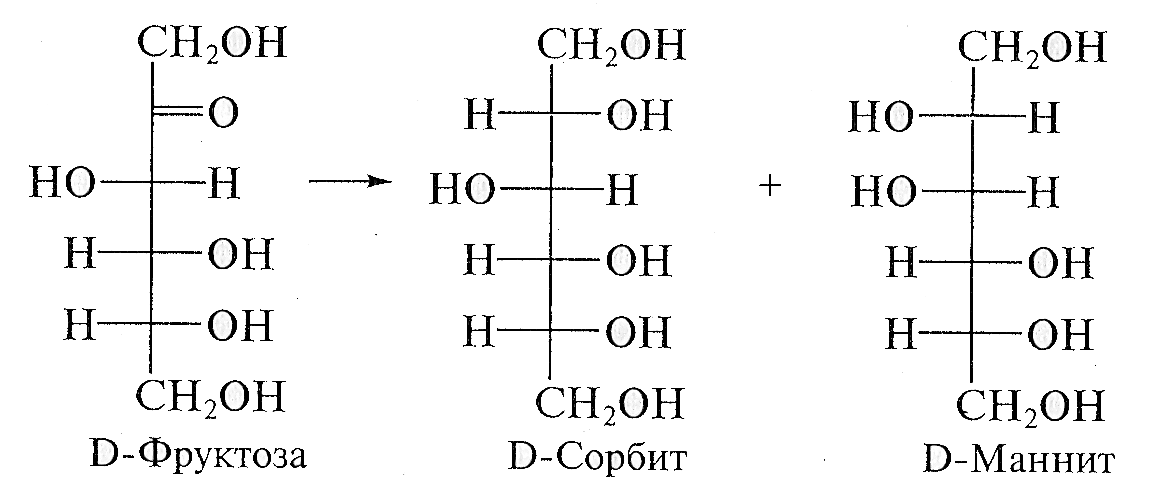
При восстановлении D-ксилозы образуется D-ксилит:
4. Реакция изомеризации (эпимеризации) всегда происходит по α-СН*-кислотному центру моносахаридов, которым является атом углерода, непосредственно связанный с карбонильной группой. Реакция протекает под действием разбавленных растворов щелочей или ферментативно (в условиях организма) и сопровождается внутримолекулярным окислением — восстановлением (диспропорционированием) атомов углерода С, и С2. В ходе этой перегруппировки вследствие переноса протона, осуществляемого под влиянием гидроксильного иона, возникает промежуточное соединение - ендиол. Превращения ендиола могут привести к образованию как кетозы, так и двух альдоз.
Таким образом, в результате реакции постепенно образуется равновесная смесь изомеров. Например, в результате эпимеризации D-глюкозы образуется D-манноза — эпимер глюкозы по С2 и D-фруктоза — структурный изомер глюкозы:
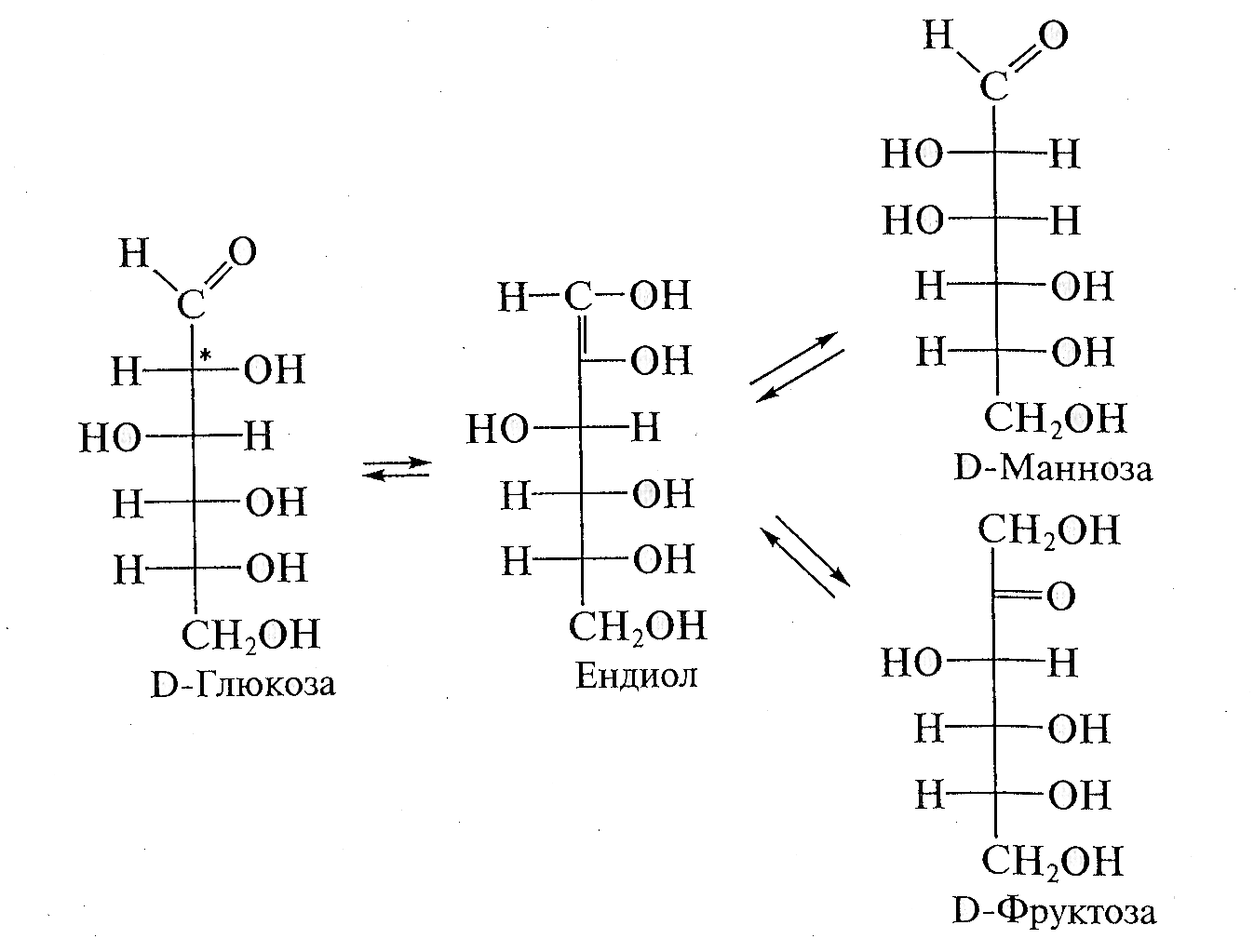
Пример реакции изомеризации в организме — ферментативное превращение глюкозо-6-фосфата в фруктозо-6-фосфат в процессе гликолиза.
