- •400066, Волгоград, пл. Павших Борцов, 1
- •Правила по технике безопасности при работе в химической лаборатории
- •Глава 1. Номенклатура и изомерия органических соединений.
- •§ 1.1. Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •§ 1.2. Основы строения и реакционной способности оргаических соединений
- •§ 1.2.1. Общая характеристика органических соединений
- •§ 1.2.2. Классификация органических соединений
- •§ 1.2.3. Номенклатура.
- •§ 1.2.3.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •§ 1.2.3.2. Радикально-функциональная номенклатура
- •Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
- •§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
- •Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
- •§ 2.1. Пространственное строение органических соединений. Стереоизомерия
- •§ 2.2. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Электронные эффекты заместителей
- •§ 2.3. Системы с замкнутой цепью сопряжения.
- •§ 2.4. Гетероциклические ароматические соединения.
- •§ 2.5. Кислотно-основные свойства органических соединений. Типы кислот и оснований. Определение понятий «кислота» и «основание».
- •§ 2.5.1. Кислоты и основания по Бренстеду
- •Значение рКа некоторых кислот Бренстеда
- •Основания Бренcтеда.
- •Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
- •§ 2.5.2. Льюисовская кислотность и основность органических соединений.
- •§ 2.5.3. Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Классификация кислот и оснований по Пирсону
- •Глава 3. Механизмы реакций органических соединений.
- •§ 3.1. Классификация органических реакций и их компонентов.
- •§ 3.2. Основные типы органических реакций
- •§ 3.3. Механизмы реакций в органической химии
- •§ 3.3.1. Реакции радикального замещения - sr
- •§ 3.3.2. Реакции нуклеофилъного замещения у тетрагонального атома углерода (sn)
- •§ 3.3.3. Реакции элиминирования ( е1 и е2).
- •§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
- •§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •§ 4.1. Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •§4.2. Химические свойства альдегидов и кетонов.
- •§ 4.3. Альдегиды и их производные
- •§ 4.3. Лабораторный практикум.
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
- •§ 5.2. Химические свойства предельных кислот и их производных
- •§ 5.3. Кислотно-основные свойства.
- •§ 5.4. Карбоновые кислоты как ацилирующие реагенты
- •Реакции декарбоксилирования
- •§ 5.5. Производные карбоновых кислот, их свойства и взаимные превращеия
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •§ 5.6. Отдельные представители амидов кислот.
- •§ 5. 7. Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •§ 5.8. Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •§ 5.9. Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Биологически активные гетерофункциональные соединения.
- •§ 6.1. Классификация поли- и гетерофункциональных соединений
- •§ 6.2. Общая характеристика реакционной способности
- •Специфические реакции.
- •§ 6.3. Аминоспирты
- •§ 6.4. Гидроксикарбоновые кислоты
- •§ 6.5. Оксокарбоновые кислоты
- •§ 6.6. Фенолокислоты. Особенности строения, свойства и биологическая роль.
- •Отдельные представители фенолокислот.
- •§ 6.7. Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически активные гетероциклические соединения.
- •§ 7.1. Понятие о гетероциклических соединениях
- •§ 7.1.1. Пятичленные гетероциклы.
- •§ 7.1.2. Шестичленные гетероциклы.
- •§ 7.1.3. Бициклические гетероциклы.
- •§7.2. Лабораторный практикум.
- •Ход работы.
- •Глава 8. Аминокислоты, пептиды, белки
- •§ 8.1.Строение и свойства аминокислот.
- •§ 8.2. Пептиды.
- •§ 8.3. Качественные реакции на аминокислоты и белки.
- •§ 8.4. Физиологическая роль и применение в медицине некоторых аминокислот
- •§ 8.5. Белки
- •1. Каталитическая функция
- •7. Защитная функция
- •§ 8.6. Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •§ 9.1. Строение и свойства углеводов.
- •§ 9.1. 1. Классификация углеводов.
- •§9.1.2. Изомерия моносахаров.
- •§9.1.3. Химические свойства моносахаридов.
- •§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара)
- •§ 9.3. Олиго- и полисахариды.
- •§ 9.3.1. Полисахариды.
- •§ 9.4. Гетерополисахариды
- •§ 9.5. Функции углеводов и их обмен
- •§ 9.6. Роль углеводов в развитии кариеса зубов
- •Контрольные вопросы
- •§ 9.7. Лабораторная работа «Свойства простых и сложных углеводов»
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •§ 10.1. Нуклеиновые основания, нуклеозиды, нуклеотиды.
- •§ 10.2. Нуклеотидный состав и структура днк и рнк.
- •§10.3. Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •§ 10.4. Лабораторная работа. «Гидролиз нуклеиновых кислот»
- •Глава 11. Омыляемые и неомыляемые липиды.
- •§ 11.1. Липиды. Строение и классификация липидов
- •§ 11.2. Простые липиды
- •§ 11.2.1. Жиры
- •Константы некоторых жиров животного и растительного происхождения
- •§ 11.2.2. Воски
- •§ 11.2.3. Стериды. Стероиды и стероидные гормоны.
- •§11.2.4.Желчные килоты
- •Стероидные гормоны
- •§ 11.3. Сложные липиды
- •§ 11.4. Лабораторный практикум «Омыляемые и неомыляемые липиды. Терпеноиды и стероиды»
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •§ 12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •§ 12.2. Поверхностная активность веществ.
- •§ 12.3. Адсорбция.
- •2. Изотерма Ленгмюра:
- •§12.4. Лабораторный практикум «Адсорбция поверхностно-активного вещества на границе раздела жидкость-воздух или жидкость-жидкость».
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •§ 13.1. Адсорбция на границе твердое тело — раствор. Влияние различных факторов на величину адсорбции.
- •§ 13.1.1. Молекулярная адсорбция.
- •§13.1.2. Адсорбция сильных электролитов.
- •§13.2. Адгезия и когезия.
- •Задание для самостоятельной подготовки
- •Контрольные вопросы
- •§13.3. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •§ 14.1. Дисперсные системы и их классификация.
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •§ 14.2. Получение и устойчивость дисперсных систем
- •§ 14.3. Строение мицелл.
- •§ 14.4. Слюна как дисперсная система.
- •§ 14.5. Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
Глава 8. Аминокислоты, пептиды, белки
Вопросы к занятию.
-
Строение и свойства аминогруппы (основность, нуклеофильность, химическое поведение). Аминокислоты: строение, изомерия и классификация.
-
Биоплярная структура аминокислот и образование хелатов.
-
Химические свойства аминокислот: кислотно-основные свойства, декарбоксилирование, переминирование, реакции по карбоксильной аминогруппе, хелатообразование.
-
Строение пептпдной связи. Лактат-лактильная таутометрия.
-
Ди- и полипептиды: методы синтеза (твёрдофазный синтез).
-
Белки и их строение и биологическая роль.
-
Качественные реакции на аминокислоты, пептиды, белки.
§ 8.1.Строение и свойства аминокислот.
(Самостоятельная работа студентов)
Аминокислоты — соединения, в молекулах которых одновременно присутствуют амино- и карбоксильные группы.
![]()
Природные α-аминокислоты являются биологически активными соединениями; их классификация приведена в табл. 19.
Строение аминокислот. Все α-аминокислоты* можно рассматривать как результат замены атома водорода в простейшей а-аминокислоте — глицине — на тот или иной радикал R. Таким образом, в соответствии с природой радикала R, называемого боковой цепью, -аминокислоты подразделяют на 4 группы, отличающиеся гидрофильностью или гидрофобностью боковых цепей, а также способностью боковой цепи проявлять кислотные или основные свойства (см. табл. 19).
Аминокислоты рассматриваются как производные карбоновых кислот, в которых положение аминогруппы относительно карбоксильной принято указывать буквами α, β, γ и т. д., что равносильно цифрам 2, 3, 4 и т. д. соответственно. Хотя в природных объектах и обнаружено около 300 разных аминокислот, но в состав большинства пептидов и белков входят 20 наиболее часто встречающихся и поэтому важных аминокислот, причем все они α-аминокислоты.
Таким образом, в α-аминокислотах карбоксильная и аминогруппы связаны с одним и тем же углеродным атомом (Сα), у которого кроме того имеется заместитель R.
R — неполярный углеводородный заместитель, проявляющий гидрофобные (липофильные) свойства. Это восемь α-аминокислот: аланин, валин, лейцин, изолейцин, пролин, фе-нилаланин, триптофан и метионин, труднорастворимые в воде.
R — неионизующийся полярный заместитель, проявляющий гидрофильные свойства. Это пять α-аминокислот, которые лучше растворяются в воде: глицин, серии, треонин, аспарагин и глутамин.
R — полярный заместитель, проявляющий гидрофильные и кислотные свойства. Это четыре α-аминокислоты: аспарагиновая и глутаминовые кислоты, цистеин и тирозин.
В аспарагиновой и глутаминовой кислотах заместитель полностью отдает протон своей карбоксильной группы в растворах с рН = 7 и поэтому, в этих условиях несет отрицательный заряд.
Таблица
Важнейшие
α-аминокислоты
![]() и
их
и
их
кислотно-основные характеристики
|
Название |
Формула |
Сокращение |
|
pI |
|
|
русское |
между-народное |
||||
|
α-Аминокислоты с неполярным (гидрофобным) заместителем R |
|||||
|
Аланин |
|
Ала |
Ala |
2,3 9,7 |
6,0 |
|
Валин (незаменимая) |
|
Вал |
Val |
2,3 9,6 |
6,0 |
|
Лейцин (незаменимая) |
|
Лей |
Leu |
2,4 9,6 |
6,0 |
|
Изолейцин (незаменимая |
|
Иле |
Ile |
2,4 9,7 |
6,1 |
|
Пролин |
|
Про |
Pro |
2,0 10,6 |
6,3 |
|
Фенилаланин (незаменимая) |
|
Фен |
Phe |
1,8 9,1 |
5,5 |
|
Триптофан (незаменимая) |
|
Три |
Trp |
2,4 9,4 |
5,9 |
|
Метионин (незаменимая) |
|
Мет |
Met |
2,3 9,2 |
5,8 |
|
α-Аминокислоты с полярным (гидрофильным) заместителем R
|
|||||
|
Глицин |
|
Глу |
Gly |
2,3 9,6 |
6,0 |
|
Серин |
|
Сер |
Ser |
2,2 9,3 |
5,7 |
|
Трионин (незаменимая) |
|
Тре |
Thn |
2,6 10,4 |
6,5 |
|
Аспарагин |
|
Асн |
Asn |
2,0 9,8 |
5,4 |
|
Глутамин |
|
Глн |
Gln |
2,2 9,1 |
5,7 |
|
α-Аминокислоты - кислотные |
|||||
|
Аспарагиновая кислота |
|
Асп |
Asp |
2,1 9,8 3,9 (COOH) |
3,0 |
|
Глутаминовая кислота |
|
Глу |
Glu |
2,2 9,7 4,3 (COOH) |
3,2 |
|
Цистеин |
|
Цис |
Cys |
1,7 10,8 8,3 (SH) |
5,0 |
|
Тирозин |
|
тир |
Tyr |
2,2 9,1 10,1 (OH) |
5,7 |
|
α-Аминокислоты - основные |
|||||
|
Лизин (незаменимая) |
|
Лиз |
Lys |
2,2 9,0 + 10,5 (NH3) |
9,8 |
|
Аргинин |
|
Арг |
Arg |
2,2 9,0 12,5 гуанидин |
10,8 |
|
Гистидин |
|
Гис |
His |
1,8 9,2 6,0 имидазол |
7,6 |
Стереохимия природных α-аминокислот характеризуется тем, что все они кроме глицина имеют асимметрический атом углерода (атом, связанный и с амино-, и с карбоксильной группой), конфигурация которого может быть отождествлена с конфигурацией L-глицеринового альдегида путем цепи химических превращений:

* За исключением нейтральной гидрофобной аминокислоты пролина (L-пирролидин-α-карбоновой кислоты).
При этом превращения либо не должны затрагивать хиральный центр, либо реакции должны протекать строго стереоспецифично. Следовательно, все природные α-аминокислоты являются L-энантиомерами.
Конфигурация асимметрического центра аминокислот определяет биологические свойства как самих аминокислот, так и олиго- и полимерных соединений, мономерами которых служат остатки аминокислот (эти соединения называют пептидами)
Свойства аминокислот. Аминокислоты представляют собой бесцветные кристаллические вещества с довольно высокими температурами плавления (более 230 °С). Большинство кислот хорошо растворимы в воде и практически не растворимы в спирте и диэтиловом эфире, что указывает на солеобразный характер этих веществ. Специфическая растворимость аминокислот обусловлена наличием в молекуле одновременно аминогруппы (имеющей основный характер) и карбоксильной группы (характеризующейся кислотными свойствами), благодаря чему аминокислоты принадлежат к амфотерным электролитам (амфолитам). В водных растворах и твердом состоянии аминокислоты существуют только в виде внутренних солей — цвиттер-ионов.
Кислотно-основное равновесие для аминокислоты может быть описано следующим образом:

Если к раствору аминокислоты приложено электрическое поле, то в зависимости от показателя рН раствора ионы аминокислоты будут перемещаться по-разному: в кислой среде при рН < 7 аммонийные ионы аминокислот перемещаются к отрицательному полюсу (катоду), а в щелочной среде при рН > 7 карбоксилат-ионы — к положительному полюсу (аноду). Значение рН, при котором молекула аминокислоты электронейтральна, называют изоэлектрической точкой и обозначают рI. При значении рН, равном показателю рI, молекула аминокислоты в электрическом поле не перемещается. Изоэлектрическую точку определяют по соотношению
pI=0.5(pKa1+pKa2)
Реакции с участием только аминогруппы. Наличие в молекуле одновременно амино- и карбоксильной группы отражается и на поведении аминокислот в тех реакциях, в которых участвует только одна из двух функциональных групп. Аминогруппа, которая в аминах проявляет себя как нуклеофил, в биполярном ионе полностью лишена нуклеофильности из-за протонирования, поэтому ни реакция алкилирования по Гофману, ни ацилирование, свойственные аминам, не имеют места в случае аминокислот. Эти реакции могут происходить только при условии предварительного депротонирования аминогруппы, что достигается использованием реакционной среды с высоким значением рН, при которых цвиттер-ион полностью превращен в карбоксилат-анион.
Рассмотрим основные реакции с участием только аминогруппы аминокислот.
1. Алкилирование осуществляют, действуя на полученные соли аминокислот алкилгалогенидами в присутствии оснований (как органических, так и неорганических).
2. Ацилирование также требует предварительного превращения цвиттер-иона в карбоксилат-анион и успешно протекает при наличии в реакционной среде эквивалента основания (основание необходимо для связывания выделяющегося при ацилировании кислого продукта — галогеноводорода или карбоновой кислоты):
![]()
или
![]()
и далее
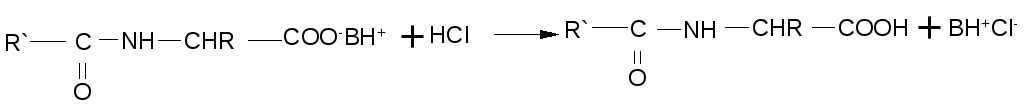
3. Образование оснований Шиффа (как типичная реакция аминов) свойственно и аминокислотам; наиболее часто используют реакции аминокислот с бензальдегидом:
![]()
На образовании оснований Шиффа основана реакция идентификации аминокислот, известная как «нингидриновая проба», широко применяемая для визуализации зон аминокислот (возникает интенсивное сине-фиолетовое окрашивание) при их хроматографическом и электрофоретическом разделении, а также для количественного определения содержания аминокислот в растворах:

4. Дезаминирование аминокислот, как и всякого первичного амина, протекает при действии на аминокислоты азотистой кислоты:
![]()
Эта реакция лежит в основе метода определения содержания азота и количества аминогрупп в аминокислотах (метод Ван-Слайка).
Биосинтез аминокислот. Все природные α-аминокислоты делят на незаменимые (валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин), которые поступают в организм только из внешней среды, и заменимые, синтез которых происходит в организме.
Биосинтез
α-аминокислот может происходить на
основе не аминокислот, например по
реакции восстановления ![]() -кетокислот
под действием НАДН:
-кетокислот
под действием НАДН:

Реакция стереоспецифична вследствие стереоспецифичности НАДН.
В качестве исходных веществ при биосинтезе аминокислот могут выступать другие аминокислоты. Например, реакция трансаминирования (переаминирования) является основной при синтезе α-аминокислот в организме:

Катализаторами и участниками этого процесса являются ферменты (аминотрансферазы) и кофермент пиридоксальфосфат, который служит переносчиком аминогруппы.