
- •400066, Волгоград, пл. Павших Борцов, 1
- •Правила по технике безопасности при работе в химической лаборатории
- •Глава 1. Номенклатура и изомерия органических соединений.
- •§ 1.1. Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •§ 1.2. Основы строения и реакционной способности оргаических соединений
- •§ 1.2.1. Общая характеристика органических соединений
- •§ 1.2.2. Классификация органических соединений
- •§ 1.2.3. Номенклатура.
- •§ 1.2.3.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •§ 1.2.3.2. Радикально-функциональная номенклатура
- •Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
- •§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
- •Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
- •§ 2.1. Пространственное строение органических соединений. Стереоизомерия
- •§ 2.2. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Электронные эффекты заместителей
- •§ 2.3. Системы с замкнутой цепью сопряжения.
- •§ 2.4. Гетероциклические ароматические соединения.
- •§ 2.5. Кислотно-основные свойства органических соединений. Типы кислот и оснований. Определение понятий «кислота» и «основание».
- •§ 2.5.1. Кислоты и основания по Бренстеду
- •Значение рКа некоторых кислот Бренстеда
- •Основания Бренcтеда.
- •Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
- •§ 2.5.2. Льюисовская кислотность и основность органических соединений.
- •§ 2.5.3. Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Классификация кислот и оснований по Пирсону
- •Глава 3. Механизмы реакций органических соединений.
- •§ 3.1. Классификация органических реакций и их компонентов.
- •§ 3.2. Основные типы органических реакций
- •§ 3.3. Механизмы реакций в органической химии
- •§ 3.3.1. Реакции радикального замещения - sr
- •§ 3.3.2. Реакции нуклеофилъного замещения у тетрагонального атома углерода (sn)
- •§ 3.3.3. Реакции элиминирования ( е1 и е2).
- •§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
- •§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •§ 4.1. Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •§4.2. Химические свойства альдегидов и кетонов.
- •§ 4.3. Альдегиды и их производные
- •§ 4.3. Лабораторный практикум.
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
- •§ 5.2. Химические свойства предельных кислот и их производных
- •§ 5.3. Кислотно-основные свойства.
- •§ 5.4. Карбоновые кислоты как ацилирующие реагенты
- •Реакции декарбоксилирования
- •§ 5.5. Производные карбоновых кислот, их свойства и взаимные превращеия
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •§ 5.6. Отдельные представители амидов кислот.
- •§ 5. 7. Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •§ 5.8. Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •§ 5.9. Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Биологически активные гетерофункциональные соединения.
- •§ 6.1. Классификация поли- и гетерофункциональных соединений
- •§ 6.2. Общая характеристика реакционной способности
- •Специфические реакции.
- •§ 6.3. Аминоспирты
- •§ 6.4. Гидроксикарбоновые кислоты
- •§ 6.5. Оксокарбоновые кислоты
- •§ 6.6. Фенолокислоты. Особенности строения, свойства и биологическая роль.
- •Отдельные представители фенолокислот.
- •§ 6.7. Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически активные гетероциклические соединения.
- •§ 7.1. Понятие о гетероциклических соединениях
- •§ 7.1.1. Пятичленные гетероциклы.
- •§ 7.1.2. Шестичленные гетероциклы.
- •§ 7.1.3. Бициклические гетероциклы.
- •§7.2. Лабораторный практикум.
- •Ход работы.
- •Глава 8. Аминокислоты, пептиды, белки
- •§ 8.1.Строение и свойства аминокислот.
- •§ 8.2. Пептиды.
- •§ 8.3. Качественные реакции на аминокислоты и белки.
- •§ 8.4. Физиологическая роль и применение в медицине некоторых аминокислот
- •§ 8.5. Белки
- •1. Каталитическая функция
- •7. Защитная функция
- •§ 8.6. Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •§ 9.1. Строение и свойства углеводов.
- •§ 9.1. 1. Классификация углеводов.
- •§9.1.2. Изомерия моносахаров.
- •§9.1.3. Химические свойства моносахаридов.
- •§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара)
- •§ 9.3. Олиго- и полисахариды.
- •§ 9.3.1. Полисахариды.
- •§ 9.4. Гетерополисахариды
- •§ 9.5. Функции углеводов и их обмен
- •§ 9.6. Роль углеводов в развитии кариеса зубов
- •Контрольные вопросы
- •§ 9.7. Лабораторная работа «Свойства простых и сложных углеводов»
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •§ 10.1. Нуклеиновые основания, нуклеозиды, нуклеотиды.
- •§ 10.2. Нуклеотидный состав и структура днк и рнк.
- •§10.3. Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •§ 10.4. Лабораторная работа. «Гидролиз нуклеиновых кислот»
- •Глава 11. Омыляемые и неомыляемые липиды.
- •§ 11.1. Липиды. Строение и классификация липидов
- •§ 11.2. Простые липиды
- •§ 11.2.1. Жиры
- •Константы некоторых жиров животного и растительного происхождения
- •§ 11.2.2. Воски
- •§ 11.2.3. Стериды. Стероиды и стероидные гормоны.
- •§11.2.4.Желчные килоты
- •Стероидные гормоны
- •§ 11.3. Сложные липиды
- •§ 11.4. Лабораторный практикум «Омыляемые и неомыляемые липиды. Терпеноиды и стероиды»
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •§ 12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •§ 12.2. Поверхностная активность веществ.
- •§ 12.3. Адсорбция.
- •2. Изотерма Ленгмюра:
- •§12.4. Лабораторный практикум «Адсорбция поверхностно-активного вещества на границе раздела жидкость-воздух или жидкость-жидкость».
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •§ 13.1. Адсорбция на границе твердое тело — раствор. Влияние различных факторов на величину адсорбции.
- •§ 13.1.1. Молекулярная адсорбция.
- •§13.1.2. Адсорбция сильных электролитов.
- •§13.2. Адгезия и когезия.
- •Задание для самостоятельной подготовки
- •Контрольные вопросы
- •§13.3. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •§ 14.1. Дисперсные системы и их классификация.
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •§ 14.2. Получение и устойчивость дисперсных систем
- •§ 14.3. Строение мицелл.
- •§ 14.4. Слюна как дисперсная система.
- •§ 14.5. Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
§ 4.3. Лабораторный практикум.
”Альдегиды и кетоны”.
Инструкция по технике безопасности.
Низшие альдегиды обладают резким раздражающим и удушающим действием. Поэтому, работать с ними необходимо под вытяжной системой.
Ход работы.
Опыт №1. Окисление альдегидов гидратом окиси меди (реакция Троммера).
Налейте в пробирку 5-10 капель раствора формалина и 2-3 мл 10%-ного раствора щёлочи. Перемешивая смесь, прилейте к ней по каплям слабый раствор медного купороса до появления очень слабой мути. Нагрейте содержимое. Что наблюдается? Напишите уравнение реакции.
Опыт №2. Окисление альдегидов аммиачным раствором оксида серебра (реакция «серебряного зеркала», реакция Толленса).
В чистую пробирку поместите 3 капли 0,2 Н AgNO3, прибавьте 8-10 капель 2Н NH4OH до растворения образующегося осадка гидроксида серебра. К прозрачному раствору добавьте 3 капли 2%-ного раствора формалина или уксусного альдегида. Слабо нагрейте смесь. Что наблюдаете? Напишите уравнение реакции.
Опыт №3. Йодоформная проба на ацетон.
К раствору ацетона прибавьте около 1 мл раствора йода. Сюда же, перемешивая, прилейте по каплям раствор едкого натра – столько. Чтобы жидкость обесцветилась. Что наблюдается? Какой ощущаете запах? Запишите результаты и схему образования йодоформа из ацетона. В выводе укажите, по какому центру в альдегиде протекает данная реакция ?

Опыт№4. Получение оксима ацетона.
В пробирку поместите по одной лопаточке солянокислого гидроксил амина, безводной соды и 10-15 капель воды. Подождите пока выделится основная масса СО2, затем охладите и добавьте при хорошем перемешивании 15 капель ацетона. Смесь разогревается и выпадают кристаллы оксима ацетона. Напишите уравнение реакции.
Опыт №5. Получение динитрофенилгидразона.
В пробирку поместите одну лопаточку 2,4-динитрофенилгидразина и такое же количество CH3COONa (кристаллы), добавьте 1 мл 2 Н раствор HCl. Хорошо перемешайте и прибавьте 2-3 капли чистого ацетона. При сильном встряхивании образуется жёлтый кристаллический осадок гидразона ацетона. Напишите схему реакции образования 2,4-динитрофенилгидразона ацетона.
Глава 5. Карбоновые кислоты. Вопросы к занятию.
-
Электронное строение карбоксильной группы.
-
Кислотность и основность карбоновых кислот с точки зрения протолитической теории.
-
Влияние на кислотность карбоновых кислот структуры органического заместителя в молекуле кислоты.
-
Классификация, изомерия и номенклатура карбоновых кислот.
-
Химические свойства карбоновых кислот.
-
Механизм реакции этерификации.
-
Хлорангидриды, ангидриды, амины и нитрилы производные карбоновых кислот.
-
Ди- и трикарбоновые кислоты и особенности их поведения.
-
Медико-биологическое значение карбоновых кислот.
§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
Органические
соединения, содержащие карбоксильную
группу![]() называются
одноосновными
карбоновыми кислотами, две – двухосновными
и т. д. В
зависимости от природы углеводородного
остатка различают карбоновые
кислоты: предельные, непредельные,
ароматические,
гетероароматические, гидрокси- и
оксокислоты, аминокислоты
и др. Одноосновные карбоновые кислоты
общей формулы
CnH2n+1COOH
называются предельными
кислотами.
называются
одноосновными
карбоновыми кислотами, две – двухосновными
и т. д. В
зависимости от природы углеводородного
остатка различают карбоновые
кислоты: предельные, непредельные,
ароматические,
гетероароматические, гидрокси- и
оксокислоты, аминокислоты
и др. Одноосновные карбоновые кислоты
общей формулы
CnH2n+1COOH
называются предельными
кислотами.
По систематической номенклатуре ИЮПАК названия карбоновых кислот образуют от названий родоначальных углеводородов с тем же числом атомов углерода с добавлением окончания -овая кислота. Названия циклических и ароматических карбоновых кислот образуют добавлением к названию родоначального углеводорода слов карбоновая кислота. Нумерацию цепи начинают с атома углерода карбоксильной группы. Для кислот использу-
ются и тривиальные названия, которые применяют также для замещенных кислот, обозначая положение заместителей греческими буквами. В этом случае углеродный атом, соседний с карбоксильной группой, обозначается как α-углерод, затем β-углерод, γ-углерод:
γ β α
R—СН2—СН3—СН2СООН и т. д.
Для
названия аниона карбоновой кислоты
RCOOӨ
используется
ее латинское тривиальное название с
суффиксом -am,
a
для
названия ее молекулярного остатка без
гидроксильной группы,
т. е. ацила
![]() - то же название, но с суффиксом -ил.
Примеры
тривиальных и систематических названий
некоторых карбоновых кислот, их
анионов и ацильных групп приведены
в табл. 12.
- то же название, но с суффиксом -ил.
Примеры
тривиальных и систематических названий
некоторых карбоновых кислот, их
анионов и ацильных групп приведены
в табл. 12.
Название функциональных производных карбоновых кислот (эфиров, амидов и т. д.) формируется на основе названий их ацильного остатка.

ассоциативный циклический димер линейные ассоциаты
Таблица 12.
Тривиальные и систематические названия некоторых монокарбоновых кислот
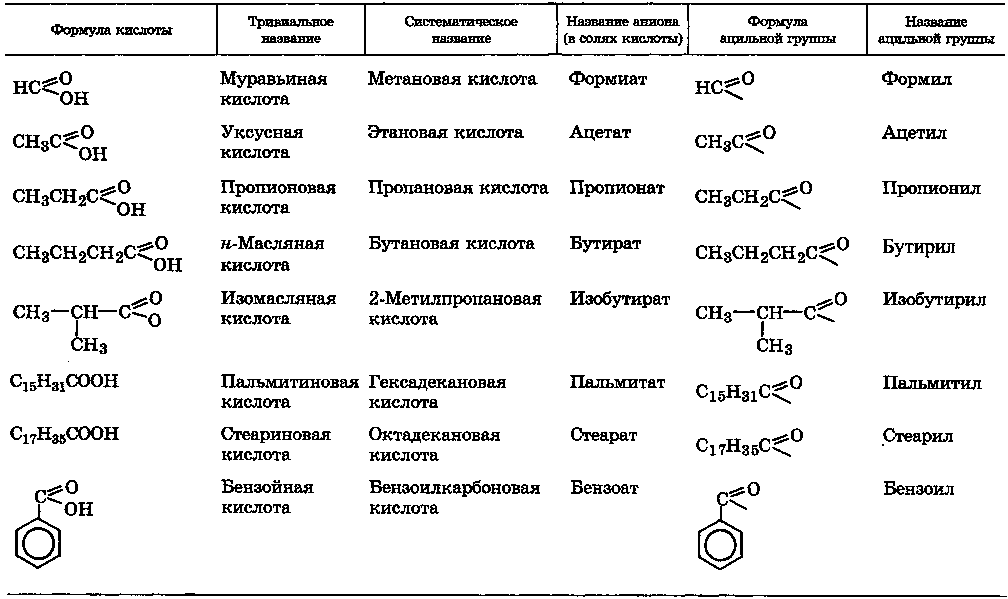
Ассоциаты карбоновых кислот частично сохраняются в растворах и даже в парах.
Плавление высших карбоновых кислот, молекулы которых имеют явно анизометрическую форму, происходит постепенно. В интервале от температуры начала плавления до температуры просветления они могут находиться в жидкокристаллическом состоянии.
Молекулы карбоновых кислот дифильны, так как содержат гидрофильный фрагмент — карбоксильную группу —СООН и гидрофобный фрагмент — углеводородную цепь —R. С увеличением длины последней дифильность молекул увеличивается, а растворимость кислот в воде уменьшается. Высшие карбоновые кислоты алифатического ряда, начиная с С10, в воде практически нерастворимы, а растворимость их солей сильно ограничена. Поэтому соли высших кислот образуют истинные растворы только при низких концентрациях, а при более высоких концентрациях - коллоидные растворы. Вследствие анизометричности молекул высших карбоновых кислот, их солей, а также их ассоциатов (мицелл) коллоидные растворы этих веществ могут находиться в лиотропном жидкокристаллическом состоянии.
Первые гомологи предельных кислот — муравьиная, уксусная и пропионовая кислоты - имеют резкий раздражающий запах, а при попадании на слизистые ткани вызывают их ожог.
