
- •400066, Волгоград, пл. Павших Борцов, 1
- •Правила по технике безопасности при работе в химической лаборатории
- •Глава 1. Номенклатура и изомерия органических соединений.
- •§ 1.1. Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •§ 1.2. Основы строения и реакционной способности оргаических соединений
- •§ 1.2.1. Общая характеристика органических соединений
- •§ 1.2.2. Классификация органических соединений
- •§ 1.2.3. Номенклатура.
- •§ 1.2.3.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •§ 1.2.3.2. Радикально-функциональная номенклатура
- •Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
- •§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
- •Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
- •§ 2.1. Пространственное строение органических соединений. Стереоизомерия
- •§ 2.2. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Электронные эффекты заместителей
- •§ 2.3. Системы с замкнутой цепью сопряжения.
- •§ 2.4. Гетероциклические ароматические соединения.
- •§ 2.5. Кислотно-основные свойства органических соединений. Типы кислот и оснований. Определение понятий «кислота» и «основание».
- •§ 2.5.1. Кислоты и основания по Бренстеду
- •Значение рКа некоторых кислот Бренстеда
- •Основания Бренcтеда.
- •Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
- •§ 2.5.2. Льюисовская кислотность и основность органических соединений.
- •§ 2.5.3. Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Классификация кислот и оснований по Пирсону
- •Глава 3. Механизмы реакций органических соединений.
- •§ 3.1. Классификация органических реакций и их компонентов.
- •§ 3.2. Основные типы органических реакций
- •§ 3.3. Механизмы реакций в органической химии
- •§ 3.3.1. Реакции радикального замещения - sr
- •§ 3.3.2. Реакции нуклеофилъного замещения у тетрагонального атома углерода (sn)
- •§ 3.3.3. Реакции элиминирования ( е1 и е2).
- •§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
- •§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •§ 4.1. Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •§4.2. Химические свойства альдегидов и кетонов.
- •§ 4.3. Альдегиды и их производные
- •§ 4.3. Лабораторный практикум.
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
- •§ 5.2. Химические свойства предельных кислот и их производных
- •§ 5.3. Кислотно-основные свойства.
- •§ 5.4. Карбоновые кислоты как ацилирующие реагенты
- •Реакции декарбоксилирования
- •§ 5.5. Производные карбоновых кислот, их свойства и взаимные превращеия
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •§ 5.6. Отдельные представители амидов кислот.
- •§ 5. 7. Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •§ 5.8. Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •§ 5.9. Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Биологически активные гетерофункциональные соединения.
- •§ 6.1. Классификация поли- и гетерофункциональных соединений
- •§ 6.2. Общая характеристика реакционной способности
- •Специфические реакции.
- •§ 6.3. Аминоспирты
- •§ 6.4. Гидроксикарбоновые кислоты
- •§ 6.5. Оксокарбоновые кислоты
- •§ 6.6. Фенолокислоты. Особенности строения, свойства и биологическая роль.
- •Отдельные представители фенолокислот.
- •§ 6.7. Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически активные гетероциклические соединения.
- •§ 7.1. Понятие о гетероциклических соединениях
- •§ 7.1.1. Пятичленные гетероциклы.
- •§ 7.1.2. Шестичленные гетероциклы.
- •§ 7.1.3. Бициклические гетероциклы.
- •§7.2. Лабораторный практикум.
- •Ход работы.
- •Глава 8. Аминокислоты, пептиды, белки
- •§ 8.1.Строение и свойства аминокислот.
- •§ 8.2. Пептиды.
- •§ 8.3. Качественные реакции на аминокислоты и белки.
- •§ 8.4. Физиологическая роль и применение в медицине некоторых аминокислот
- •§ 8.5. Белки
- •1. Каталитическая функция
- •7. Защитная функция
- •§ 8.6. Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •§ 9.1. Строение и свойства углеводов.
- •§ 9.1. 1. Классификация углеводов.
- •§9.1.2. Изомерия моносахаров.
- •§9.1.3. Химические свойства моносахаридов.
- •§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара)
- •§ 9.3. Олиго- и полисахариды.
- •§ 9.3.1. Полисахариды.
- •§ 9.4. Гетерополисахариды
- •§ 9.5. Функции углеводов и их обмен
- •§ 9.6. Роль углеводов в развитии кариеса зубов
- •Контрольные вопросы
- •§ 9.7. Лабораторная работа «Свойства простых и сложных углеводов»
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •§ 10.1. Нуклеиновые основания, нуклеозиды, нуклеотиды.
- •§ 10.2. Нуклеотидный состав и структура днк и рнк.
- •§10.3. Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •§ 10.4. Лабораторная работа. «Гидролиз нуклеиновых кислот»
- •Глава 11. Омыляемые и неомыляемые липиды.
- •§ 11.1. Липиды. Строение и классификация липидов
- •§ 11.2. Простые липиды
- •§ 11.2.1. Жиры
- •Константы некоторых жиров животного и растительного происхождения
- •§ 11.2.2. Воски
- •§ 11.2.3. Стериды. Стероиды и стероидные гормоны.
- •§11.2.4.Желчные килоты
- •Стероидные гормоны
- •§ 11.3. Сложные липиды
- •§ 11.4. Лабораторный практикум «Омыляемые и неомыляемые липиды. Терпеноиды и стероиды»
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •§ 12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •§ 12.2. Поверхностная активность веществ.
- •§ 12.3. Адсорбция.
- •2. Изотерма Ленгмюра:
- •§12.4. Лабораторный практикум «Адсорбция поверхностно-активного вещества на границе раздела жидкость-воздух или жидкость-жидкость».
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •§ 13.1. Адсорбция на границе твердое тело — раствор. Влияние различных факторов на величину адсорбции.
- •§ 13.1.1. Молекулярная адсорбция.
- •§13.1.2. Адсорбция сильных электролитов.
- •§13.2. Адгезия и когезия.
- •Задание для самостоятельной подготовки
- •Контрольные вопросы
- •§13.3. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •§ 14.1. Дисперсные системы и их классификация.
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •§ 14.2. Получение и устойчивость дисперсных систем
- •§ 14.3. Строение мицелл.
- •§ 14.4. Слюна как дисперсная система.
- •§ 14.5. Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
Реакции
нуклеофильного замещения с участием
![]() -
гибридизованного атома углерода.
Механизм реакций этого типа рассмотрим
на примере взаимодействия карбоновых
кислот со спиртами (реакция
этерификации). В карбоксильной группе
кислоты реализуется p,
-
гибридизованного атома углерода.
Механизм реакций этого типа рассмотрим
на примере взаимодействия карбоновых
кислот со спиртами (реакция
этерификации). В карбоксильной группе
кислоты реализуется p,![]() -сопряжение,
поскольку пара электронов атома
кислорода гидроксильной группы ОН
вступает в сопряжение с двойной
углерод-кислородной связью (
-сопряжение,
поскольку пара электронов атома
кислорода гидроксильной группы ОН
вступает в сопряжение с двойной
углерод-кислородной связью (![]() -связью):
-связью):

Такое сопряжение
является причиной, с одной стороны,
повышенной кислотности карбоксильных
соединений, а с другой — уменьшения
частичного положительного заряда (![]() )
на атоме углерода карбоксильной группы
(
)
на атоме углерода карбоксильной группы
(![]() -гибридизованном
атоме), что значительно затрудняет
непосредственную атаку нуклеофила. С
целью увеличения заряда на атоме углерода
используют дополнительное протонирование
— кислотный катализ (стадия I):
-гибридизованном
атоме), что значительно затрудняет
непосредственную атаку нуклеофила. С
целью увеличения заряда на атоме углерода
используют дополнительное протонирование
— кислотный катализ (стадия I):


На стадии II
происходит атака нуклеофила (молекулы
спирта![]() ),
протонирование гидроксильной группы
с образованием хорошоуходящей группы
),
протонирование гидроксильной группы
с образованием хорошоуходящей группы
![]() ,
на стадии III — ее отщепление и а стадии
IV — регенерация протона — возврат
катализатора с образованием конечного
продукта — сложного эфира. Реакция
обратима, что наблюдается при гидролизе
сложных эфиров, гидролизе жиров в
биосистемах.
,
на стадии III — ее отщепление и а стадии
IV — регенерация протона — возврат
катализатора с образованием конечного
продукта — сложного эфира. Реакция
обратима, что наблюдается при гидролизе
сложных эфиров, гидролизе жиров в
биосистемах.
Реакции
нуклеофильного присоединения. Наиболее
характерны реакции нуклеофильного
присоединения (![]() )
для оксосоединений - альдегидов и
кетонов. Механизм этих реакций имеет
общие черты, это двухстадийный ионный
процесс. Первая стадия (лимитирующая)
представляет собой обратимую атаку
нуклеофилом Nu: с образованием так
называемого тетраэдрического интермедиата.
Вторая стадия — быстрая атака электрофилом:
)
для оксосоединений - альдегидов и
кетонов. Механизм этих реакций имеет
общие черты, это двухстадийный ионный
процесс. Первая стадия (лимитирующая)
представляет собой обратимую атаку
нуклеофилом Nu: с образованием так
называемого тетраэдрического интермедиата.
Вторая стадия — быстрая атака электрофилом:

На реакционную
способность оксосоединения оказывает
влияние природа групп R и
![]() .
Так, введение электронодонорных
заместителей снижает реакционную
способность, а электроноакцепторных —
усиливает. Поэтому альдегиды более
активны в реакциях
.
Так, введение электронодонорных
заместителей снижает реакционную
способность, а электроноакцепторных —
усиливает. Поэтому альдегиды более
активны в реакциях
![]() ,
чем кетоны. Кроме того, реакционная
способность зависит от природы нуклеофила.
Например, тиолы RSH, являясь более сильными
нуклеофилами, чем спирты ROH, вступают в
реакцию
,
чем кетоны. Кроме того, реакционная
способность зависит от природы нуклеофила.
Например, тиолы RSH, являясь более сильными
нуклеофилами, чем спирты ROH, вступают в
реакцию
![]() как с альдегидами, так и с кетонами,
образуя устойчивые к гидролизу тиоацетали,
тогда как ацетали — продукты присоединения
спиртов к альдегидам — к гидролизу не
устойчивы:
как с альдегидами, так и с кетонами,
образуя устойчивые к гидролизу тиоацетали,
тогда как ацетали — продукты присоединения
спиртов к альдегидам — к гидролизу не
устойчивы:
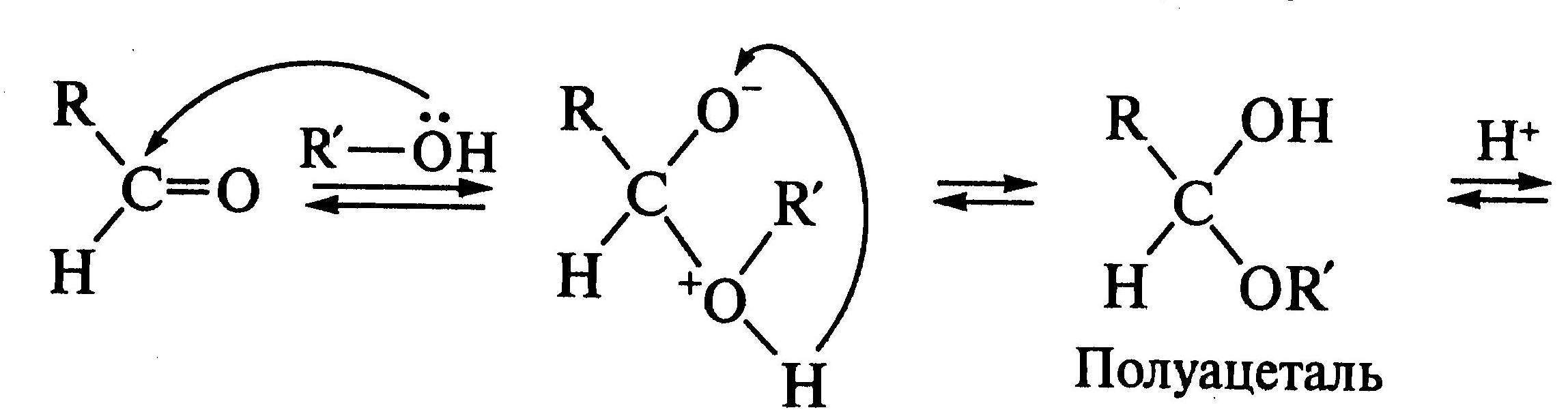

Обратите внимание,
что последние стадии процесса представляют
собой атаку нуклеофила (молекулы спирта
![]() )
на электрофильный реакционный центр
(карбкатион) и идут по механизму
нуклеофильного замещения
)
на электрофильный реакционный центр
(карбкатион) и идут по механизму
нуклеофильного замещения
![]() .
Образующиеся промежуточные соединения
— полуацетали — являются неустойчивыми.
Стабилизация их возможна только в
циклической форме при образовании
циклических полуацеталей, например
5-гидроксипентаналя:
.
Образующиеся промежуточные соединения
— полуацетали — являются неустойчивыми.
Стабилизация их возможна только в
циклической форме при образовании
циклических полуацеталей, например
5-гидроксипентаналя:

Другой пример
биологически важной реакции этого типа
— присоединение аминов и некоторых
других азотсодержащих соединений к
карбонильным соединениям — альдегидам
и кетонам. Реакция идет по механизму
нуклеофильного присоединения—элиминирования
(![]() —E),
или нуклеофильного присоединения-
отщепления:
—E),
или нуклеофильного присоединения-
отщепления:

Другие азотсодержащие
соединения, выступающие в этих реакциях
в роли нуклеофила: гидразин![]() ,
гидроксиламин
,
гидроксиламин![]() ,
фенилгидразин
,
фенилгидразин![]() .
.
Продуктами
реакций![]() —Е
в этих случаях являются соединения
общей формулы
—Е
в этих случаях являются соединения
общей формулы
![]()
называемые
гидразонами (X =![]() ),
оксимами (X = ОН),
фенил-гидразонами (X =
),
оксимами (X = ОН),
фенил-гидразонами (X =
![]() ),
иминами (X = R),
что будет более подробно рассмотрено
в соответствующих разделах.
),
иминами (X = R),
что будет более подробно рассмотрено
в соответствующих разделах.
Помимо указанных реакций присоединения возможны реакции AdR - свободнорадикального присоединения и полимеризации или поликонденсации.
AdR - свободнорадикальное присоединение
![]()
углеводороды углеводороды
4.Реакции полимеризации — особый тип реакций присоединения, в ходе которых молекулы вещества с небольшой молекулярной массой соединяются друг с другом с образованием молекул вещества с очень высокой молекулярной массой — макромолекул.
![]()
Взаимодействие фенола с формальдегидом можно описать схемой:

димер
В ходе дальнейших стадий образуется полимер, а побочным продуктом реакции поликонденсации, в данном случае, является вода.
