
- •400066, Волгоград, пл. Павших Борцов, 1
- •Правила по технике безопасности при работе в химической лаборатории
- •Глава 1. Номенклатура и изомерия органических соединений.
- •§ 1.1. Теория строения органических соединений а.М. Бутлерова.
- •Свойства вещества определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.Е. Химическим строением вещества.
- •Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
- •§ 1.2. Основы строения и реакционной способности оргаических соединений
- •§ 1.2.1. Общая характеристика органических соединений
- •§ 1.2.2. Классификация органических соединений
- •§ 1.2.3. Номенклатура.
- •§ 1.2.3.1. Заместительная номенклатура
- •Некоторые характеристические группы, обозначаемые только префиксами
- •Порядок старшинства характеристических групп, обозначаемых префиксами и суффиксами
- •Номенклатуре
- •§ 1.2.3.2. Радикально-функциональная номенклатура
- •Названия классов соединений, используемые в радикально-функциональной номенклатуре (в порядке убывания старшинства)
- •§ 1.3. Пространствеая структура биоорганических молекул. Виды изомерии
- •Глава 2. Электронное строение органических молекул. Кислотность и основность органических соединений.
- •§ 2.1. Пространственное строение органических соединений. Стереоизомерия
- •§ 2.2. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •Электронные эффекты заместителей
- •§ 2.3. Системы с замкнутой цепью сопряжения.
- •§ 2.4. Гетероциклические ароматические соединения.
- •§ 2.5. Кислотно-основные свойства органических соединений. Типы кислот и оснований. Определение понятий «кислота» и «основание».
- •§ 2.5.1. Кислоты и основания по Бренстеду
- •Значение рКа некоторых кислот Бренстеда
- •Основания Бренcтеда.
- •Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
- •§ 2.5.2. Льюисовская кислотность и основность органических соединений.
- •§ 2.5.3. Концепция жестких и мягких кислот и оснований (принцип жмко)
- •Классификация кислот и оснований по Пирсону
- •Глава 3. Механизмы реакций органических соединений.
- •§ 3.1. Классификация органических реакций и их компонентов.
- •§ 3.2. Основные типы органических реакций
- •§ 3.3. Механизмы реакций в органической химии
- •§ 3.3.1. Реакции радикального замещения - sr
- •§ 3.3.2. Реакции нуклеофилъного замещения у тетрагонального атома углерода (sn)
- •§ 3.3.3. Реакции элиминирования ( е1 и е2).
- •§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
- •§ 3.3.5. Реакции нуклеофильного замещения, нуклеофильного присоединения ( реакции присоединения-отщепления).
- •Глава 4. Оксосоединения (альдегиды и кетоны).
- •§ 4.1. Общая характеристика реакционной способности
- •Альдегиды и кетоны
- •§4.2. Химические свойства альдегидов и кетонов.
- •§ 4.3. Альдегиды и их производные
- •§ 4.3. Лабораторный практикум.
- •Ход работы.
- •Глава 5. Карбоновые кислоты. Вопросы к занятию.
- •§ 5.1. Строение, номенклатура и физико-химические свойства карбоновых кислот
- •§ 5.2. Химические свойства предельных кислот и их производных
- •§ 5.3. Кислотно-основные свойства.
- •§ 5.4. Карбоновые кислоты как ацилирующие реагенты
- •Реакции декарбоксилирования
- •§ 5.5. Производные карбоновых кислот, их свойства и взаимные превращеия
- •Функциональные производные карбоновых кислоты
- •Сложные эфиры, имеющие приятный аромат
- •§ 5.6. Отдельные представители амидов кислот.
- •§ 5. 7. Дикарбоновые кислоты
- •Некоторые дикарбоновые кислоты, их названия и кислотные свойства
- •§ 5.8. Ненасыщенные карбоновые кислоты
- •Содержание высших ненасыщенных кислот в растительных маслах, % по массе
- •§ 5.9. Лабораторный практикум.
- •Инструкция по технике безопасности.
- •Ход работы.
- •Глава 6. Биологически активные гетерофункциональные соединения.
- •§ 6.1. Классификация поли- и гетерофункциональных соединений
- •§ 6.2. Общая характеристика реакционной способности
- •Специфические реакции.
- •§ 6.3. Аминоспирты
- •§ 6.4. Гидроксикарбоновые кислоты
- •§ 6.5. Оксокарбоновые кислоты
- •§ 6.6. Фенолокислоты. Особенности строения, свойства и биологическая роль.
- •Отдельные представители фенолокислот.
- •§ 6.7. Лабораторный практикум.
- •Ход работы.
- •Глава 7. Биологически активные гетероциклические соединения.
- •§ 7.1. Понятие о гетероциклических соединениях
- •§ 7.1.1. Пятичленные гетероциклы.
- •§ 7.1.2. Шестичленные гетероциклы.
- •§ 7.1.3. Бициклические гетероциклы.
- •§7.2. Лабораторный практикум.
- •Ход работы.
- •Глава 8. Аминокислоты, пептиды, белки
- •§ 8.1.Строение и свойства аминокислот.
- •§ 8.2. Пептиды.
- •§ 8.3. Качественные реакции на аминокислоты и белки.
- •§ 8.4. Физиологическая роль и применение в медицине некоторых аминокислот
- •§ 8.5. Белки
- •1. Каталитическая функция
- •7. Защитная функция
- •§ 8.6. Лабораторный практикум.
- •Ход работы:
- •Глава 9. Углеводы.
- •§ 9.1. Строение и свойства углеводов.
- •§ 9.1. 1. Классификация углеводов.
- •§9.1.2. Изомерия моносахаров.
- •§9.1.3. Химические свойства моносахаридов.
- •§ 9.2. Производные моносахаридов (дезоксисахара и аминосахара)
- •§ 9.3. Олиго- и полисахариды.
- •§ 9.3.1. Полисахариды.
- •§ 9.4. Гетерополисахариды
- •§ 9.5. Функции углеводов и их обмен
- •§ 9.6. Роль углеводов в развитии кариеса зубов
- •Контрольные вопросы
- •§ 9.7. Лабораторная работа «Свойства простых и сложных углеводов»
- •Глава 10. Нуклеиновые кислоты, их структура и свойства. Вопросы к занятию:
- •§ 10.1. Нуклеиновые основания, нуклеозиды, нуклеотиды.
- •§ 10.2. Нуклеотидный состав и структура днк и рнк.
- •§10.3. Биологические функции нуклеиновых кислот.
- •Контрольные вопросы
- •§ 10.4. Лабораторная работа. «Гидролиз нуклеиновых кислот»
- •Глава 11. Омыляемые и неомыляемые липиды.
- •§ 11.1. Липиды. Строение и классификация липидов
- •§ 11.2. Простые липиды
- •§ 11.2.1. Жиры
- •Константы некоторых жиров животного и растительного происхождения
- •§ 11.2.2. Воски
- •§ 11.2.3. Стериды. Стероиды и стероидные гормоны.
- •§11.2.4.Желчные килоты
- •Стероидные гормоны
- •§ 11.3. Сложные липиды
- •§ 11.4. Лабораторный практикум «Омыляемые и неомыляемые липиды. Терпеноиды и стероиды»
- •II. Некоторые свойства скипидара.
- •III. Качественные реакции на холестерин и жёлчные кислоты.
- •IV. Качественная реакция на витамин d2 (кальциферол).
- •Глава 12. Адсорбция на подвижной границе раздела фаз.
- •§ 12.1. Поверхностная энергия и поверхностное натяжение.
- •Поверхностное натяжение жидкостей на границе с воздухом (298 к)
- •§ 12.2. Поверхностная активность веществ.
- •§ 12.3. Адсорбция.
- •2. Изотерма Ленгмюра:
- •§12.4. Лабораторный практикум «Адсорбция поверхностно-активного вещества на границе раздела жидкость-воздух или жидкость-жидкость».
- •Ход работы.
- •Глава 13. Адсорбция на неподвижной границе раздела фаз. Изотерма адсорбции уксусной кислоты на угле.
- •§ 13.1. Адсорбция на границе твердое тело — раствор. Влияние различных факторов на величину адсорбции.
- •§ 13.1.1. Молекулярная адсорбция.
- •§13.1.2. Адсорбция сильных электролитов.
- •§13.2. Адгезия и когезия.
- •Задание для самостоятельной подготовки
- •Контрольные вопросы
- •§13.3. Лабораторный практикум.
- •Ход работы.
- •Глава 14. Физикохимия дисперсных систем
- •§ 14.1. Дисперсные системы и их классификация.
- •По размерам частиц дисперсной фазы
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- •§ 14.2. Получение и устойчивость дисперсных систем
- •§ 14.3. Строение мицелл.
- •§ 14.4. Слюна как дисперсная система.
- •§ 14.5. Лабораторный практикум.
- •Ход работы.
- •Литература основная литература
- •Дополнительная литература
§ 3.3.3. Реакции элиминирования ( е1 и е2).
(Самостоятельная работа студентов)
Механизм E1 (отщепление молекулярное, I порядка).
Субстраты: третичные спирты, третичные галогенопроизводные.
Условия:
Катализатор - конц. H2SO4
1-я стадия — протонирование субстрата, преследует 2 цели:

третичный спирт карбокатион
2-я стадия — образовавшийся карбокатион не стабилен, поэтому стабилизация его происходит за счет выброса протона (H+):

В результате реакции третичные спирты, отщепляя воду [Е], превращаются в непредельные углеводороды — алкены.
![]()
![]()
Б) Механизм Е2 (отщепление бимолекулярное, второго порядка)
Субстраты: первичные спирты, галогенопроизводные Условия — безводные, спиртовые растворы сильной щелочи.
1-я стадия — атака ОН-группой водорода, стоящего в β-положении с образованием переходного комплекса:


а)
б) Na+ + Br- → Na Br
Атаку ОН– группой водорода в β-положении (β-элиминирование) легко объяснить смещением реакции в сторону образования более термодинамически устойчивого кар-бокатиона, чем это имело бы место при α-элиминировании.
§ 3.3.4. Реакции электрофильного присоединения, электрофильного замещения.
Электрофильные
реакции. Механизм электрофильных
реакций заключается в атаке электрофила
на нуклеофильный реакционный центр
(N-центр). В качестве такого центра в
молекуле субстрата чаще всего
выступает кратная связь (sp- или
![]() -гибридизованные
атомы углерода), ароматическое (бензольное)
ядро, поскольку в этих случаях имеется
область повышенной
-гибридизованные
атомы углерода), ароматическое (бензольное)
ядро, поскольку в этих случаях имеется
область повышенной
![]() -электронной
плотности.
-электронной
плотности.
Атакующая частица
— электрофил — может образоваться в
результате либо гетеролиза связи,
например:![]() ,
либо поляризации ковалентной связи
вблизи N-центра. В последнем случае
образуется так называемый индуцированный
(или наведенный) диполь:
,
либо поляризации ковалентной связи
вблизи N-центра. В последнем случае
образуется так называемый индуцированный
(или наведенный) диполь:
![]() .
.
Реакции электрофильного присоединения (АЕ). Различают два основных механизма реакций электрофильного присоединения.
1.
![]() -Комплексный
механизм. Такой путь реакции характерен
прежде всего при присоединении неполярных
и малополярных веществ к соединениям,
содержащим двойную углерод- углеродную
связь. Рассмотрим механизм реакции на
примере присоединения брома.
Обогащенный электронами реакционный
центр поляризует молекулу брома,
придавая ей электрофильные свойства;
образуется активный комплекс интермедиат
- циклический бромониевый ион. Стадия
I является лимитирующей стадией процесса.
Далее быстро происходит атака нуклеофильной
частицы
-Комплексный
механизм. Такой путь реакции характерен
прежде всего при присоединении неполярных
и малополярных веществ к соединениям,
содержащим двойную углерод- углеродную
связь. Рассмотрим механизм реакции на
примере присоединения брома.
Обогащенный электронами реакционный
центр поляризует молекулу брома,
придавая ей электрофильные свойства;
образуется активный комплекс интермедиат
- циклический бромониевый ион. Стадия
I является лимитирующей стадией процесса.
Далее быстро происходит атака нуклеофильной
частицы
![]() со стороны, противоположной
со стороны, противоположной
![]() (так называемое антиприсоединение),
что объясняется пространственными
затруднениями из-за достаточно больших
размеров атома брома (стадия II). Для
реакции характерен кислотный катализ,
в том числе катализ кислотами Льюиса:
(так называемое антиприсоединение),
что объясняется пространственными
затруднениями из-за достаточно больших
размеров атома брома (стадия II). Для
реакции характерен кислотный катализ,
в том числе катализ кислотами Льюиса:

2. Карбкатионный
механизм. Такой путь реакции реализуется
при присоединении полярных частиц
(HHal,
![]() и
др.); лимитирующей стадией реакции
является протонирование двойной связи
(стадия I) с образованием карбкатиона,
с последующей быстрой атакой
нуклеофильной частицы (
и
др.); лимитирующей стадией реакции
является протонирование двойной связи
(стадия I) с образованием карбкатиона,
с последующей быстрой атакой
нуклеофильной частицы (![]() )
на электронодефицитный атом углерода
(стадия II); например, присоединение
бромоводорода:
)
на электронодефицитный атом углерода
(стадия II); например, присоединение
бромоводорода:

Реакция нестереоспецифична. При присоединении галогеноводородов их реакционная способность (и скорость реакции) снижается в ряду: HI, НВг, НС1, HF.
Реакции гидратации
(реакции присоединения воды) идут в
условиях кислотного катализа. Кислоты
образуют при ионизации ионы, обладающие
довольно слабыми нуклеофильными
свойствами:![]() .
Образующийся при протонировании
карбкатион атакуется нуклеофилом -
молекулой воды — с образованием
алкилоксониевого иона. Последний
стабилизируется путем отщепления
протона в результате гетеролиза связи
О—Н, происходит «возврат катализатора»,
реакция обратима. Обратная реакция
— катализируемая кислотами дегидратация
спиртов:
.
Образующийся при протонировании
карбкатион атакуется нуклеофилом -
молекулой воды — с образованием
алкилоксониевого иона. Последний
стабилизируется путем отщепления
протона в результате гетеролиза связи
О—Н, происходит «возврат катализатора»,
реакция обратима. Обратная реакция
— катализируемая кислотами дегидратация
спиртов:

Образование алкилоксониевого иона является лимитирующей стадией реакции. Кроме того, реакция может протекать по π - комплексному механизму, при котором на первой стадии образуется активированный комплекс:

на который и направлена атака нуклеофила — молекулы воды.
Рассмотрим два возможных пути присоединения бромоводорода к пропену:
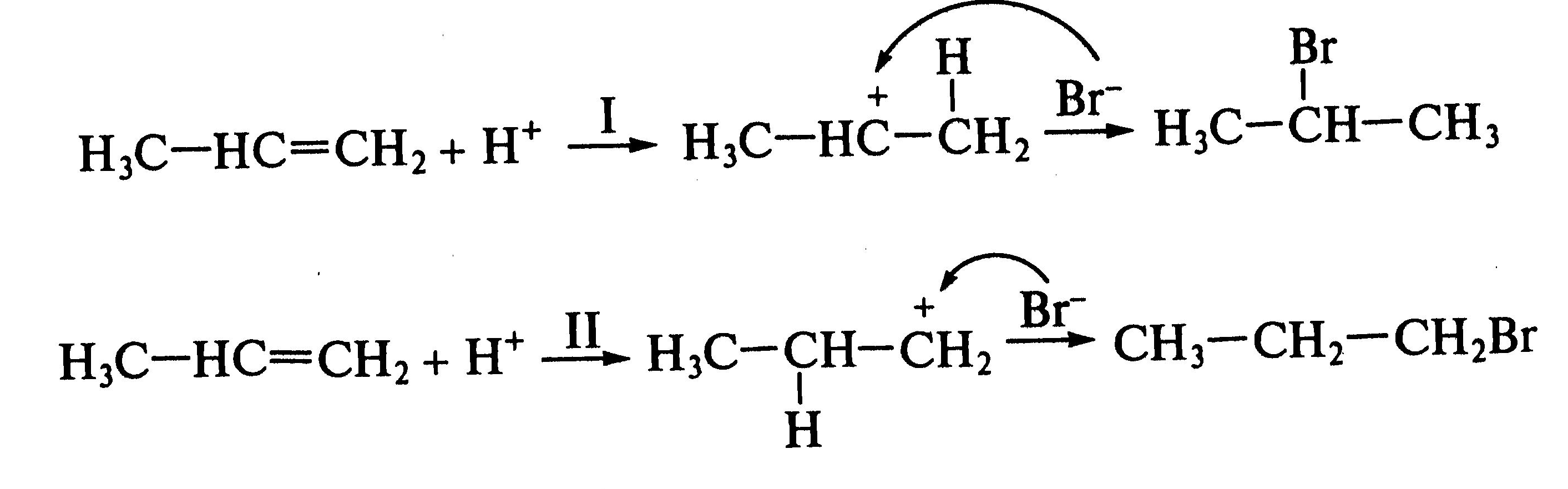
На направление
атаки электрофила
![]() влияют прежде всего два фактора.
влияют прежде всего два фактора.
1.Перераспределение
электронной плотности
![]() -связи
вследствие положительного индуктивного
эффекта окружения (метальной группы
-связи
вследствие положительного индуктивного
эффекта окружения (метальной группы
![]() ):
):
![]()
Электрофил
предпочтительно атакует атом углерода
с повышенной электронной плотностью,
т.е. реакция
![]() будет
протекать по первому пути.
будет
протекать по первому пути.
2.Устойчивость
образующихся карбкатионов. Образующийся
в результате атаки по первому пути
вторичный.карбкатион
![]() является более устойчивым, чем первичный
является более устойчивым, чем первичный
![]() - продукт атаки электрофила по второму
пути. Еще большей устойчивостью
обладают
третичные карбкатионы
- продукт атаки электрофила по второму
пути. Еще большей устойчивостью
обладают
третичные карбкатионы
![]() .
.
Следовательно, влияние обоих факторов приводит к образованию 2-бромпропана (первый путь). Кратко данный механизм определяется правилом В.В. Марковникова.
При присоединении к несимметричным алкенам полярных реагентов типа НХ электрофильная частица протон ( Н+ ) присоединяется к более гидрогенизированному атому углерода, а анион Х- - к менее гидрогенизированному атому углерода при двойной связи.
На скорость реакции
![]() оказывает влияние строение субстрата,
т. е. ближайшее окружение реакционного
центра. Так, электронодонорные заместители
увеличивают скорость реакции, облегчая
присоединение (повышают электронную
плотность внутри реакционного центра),
а электроноакцепторные заместители
снижают скорость реакции, затрудняя
присоединение электрофила. Снижение
скорости реакции происходит в ряду:
оказывает влияние строение субстрата,
т. е. ближайшее окружение реакционного
центра. Так, электронодонорные заместители
увеличивают скорость реакции, облегчая
присоединение (повышают электронную
плотность внутри реакционного центра),
а электроноакцепторные заместители
снижают скорость реакции, затрудняя
присоединение электрофила. Снижение
скорости реакции происходит в ряду:
![]()
Сопряжение
увеличивает реакционную способность
двойной углерод- углеродной связи в
отношении электрофилов и соответственно
повышает скорость реакций
![]() .
Процесс протекает через последовательные
стадии, связанные с образованием
карбкатиона, так как он стабилизируется
за счет делокализации заряда:
.
Процесс протекает через последовательные
стадии, связанные с образованием
карбкатиона, так как он стабилизируется
за счет делокализации заряда:

Протонирование
идет по второму пути, поскольку в этом
случае образуется сопряженная система
аллильного типа за счет взаимодействия
электронодефицитного атома углерода
с
![]() -
электронами двойной связи:
-
электронами двойной связи:
![]()
Карбкатион аллильного типа является активным электрофильным алкилирующем агентом в живых организмах. Делокализация электронной плотности в результате образования сопряженной системы предопределяет два возможных направления атаки нуклеофилом:

Таким образом, в результате реакции образуется смесь продуктов 1,2-присоединения (второй путь) и 1,4-присоединения (первый путь), состав которой зависит от условий реакций.
Соединения с
тройной связью, содержащие атомы углерода
в состоянии
![]() -гибридизации,
в целом менее реакционноспособны в
реакциях
-гибридизации,
в целом менее реакционноспособны в
реакциях
![]() .
Образующийся в результате протонирования
карбкатион - винилкатион - является
малоустойчивым. На стадии депротонирования
оксониевого иона в результате сдвига
таутомерного равновесия (кето-енольная
таутомерия) образуются оксосоединения
(кетоны):
.
Образующийся в результате протонирования
карбкатион - винилкатион - является
малоустойчивым. На стадии депротонирования
оксониевого иона в результате сдвига
таутомерного равновесия (кето-енольная
таутомерия) образуются оксосоединения
(кетоны):
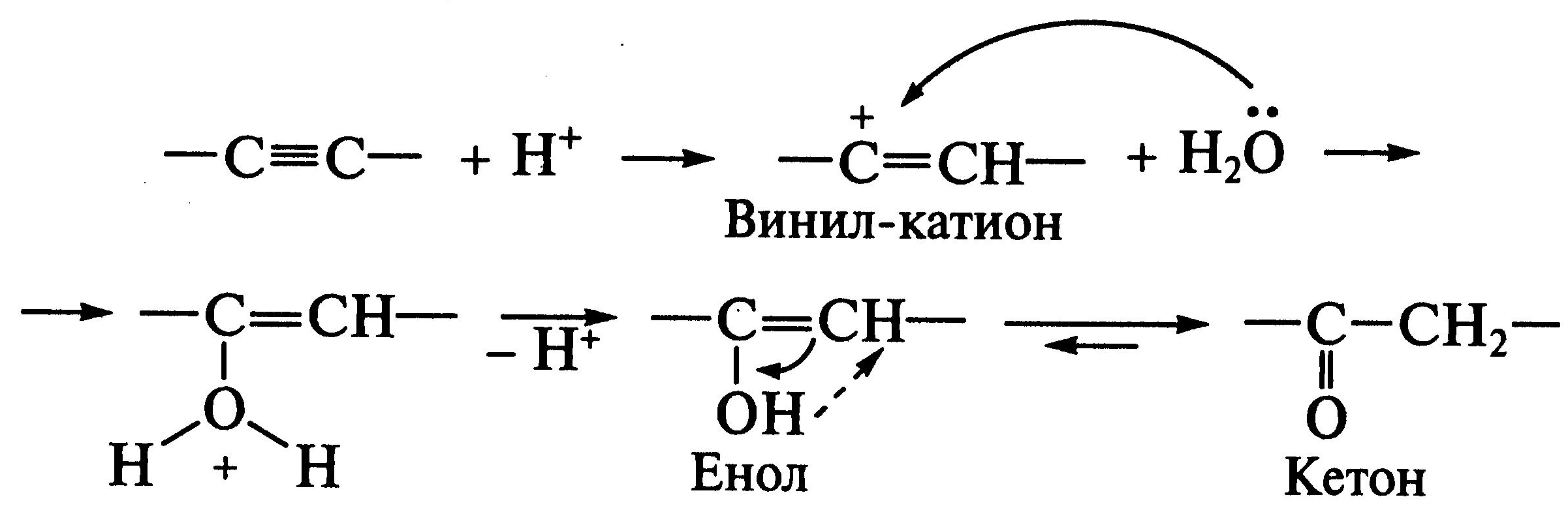
Реакции электрофильного замещения(SE). Для ароматических соединений бензольного рада, конденсированных и гетероциклических ароматических соединений характерны реакции электрофильного замещения.



Образовавшаяся
электрофильная частица
![]() атакует
нуклеофильный центр - бензольное ядро.
В результате атаки образуется неустойчивая
структура (
атакует
нуклеофильный центр - бензольное ядро.
В результате атаки образуется неустойчивая
структура (![]() -комплекс)
с нарушенной системой кругового
сопряжения. Эта стадия является
лимитирующей (стадия I). Стабилизация
структуры происходит путем отщепления
протона от
-комплекс)
с нарушенной системой кругового
сопряжения. Эта стадия является
лимитирующей (стадия I). Стабилизация
структуры происходит путем отщепления
протона от
![]() -комплекса
с образованием конечного продукта.
-комплекса
с образованием конечного продукта.
По этому механизму (SЕ) с выше перечисленными субстратами протекают реакции нитрования, сульфирования, алкилирования, галогенирования, ацилирования.
Механизм реакции SЕ на примере нитрования бензола:
-
Образование электрофильной частицы — иона нитрония (NO2+):
![]()
2. Образование π -комплекса:
![]()
бензол π -комплекс
3. Образование σ-комплекса
![]()
π - комплекс σ – комплекс
В σ -комплексе один углерод переходит в состояние sp3 гибридизации, ароматичность нарушается, комплекс неустойчив и стабилизация его происходит путем выброса Н+.
4. Образование нитробензола:
![]()
σ–комплекс мононитробензол
5.
Н+
+ НSO![]() → Н2SO4
(регенерация катализатора)
→ Н2SO4
(регенерация катализатора)
Влияние заместителей на реакционную способность в ходе SE
Однозамещенные бензола изомеров не имеют, но если в кольце появляются заместители, то симметрия кольца нарушена и с помощью квантово-механических расчетов удалось установить, что все заместители делятся на две группы:
|
I рода
Электродонорные
(ЭД) - за
исключением галогенов. Они повышают
электронную плотность кольца, особенно,
в орто- и пара- положениях. К ним
относятся: –ОН; –NH2,
–CH3,
–О–R; –NHR; Cl; Br; I. Заместители I рода направляют вновь прибывающие группы в орто- и пара-положения |
II рода
Электроноакцепторные
(ЭА); они понижают электронную плотность
кольца, особенно, в орто- и пара-
положениях. К ним относятся заместители,
имеющие в своем составе двойную связь,
т.к. при этом происходит π-π-сопряжение:
Заместители II рода направляют прибывающие группы в мета-положение |
Таким образом, как
и в случае реакций
![]() на реакционную способность и скорость
реакции
на реакционную способность и скорость
реакции
![]() оказывает влияние структура субстрата,
т. е. окружение реакционного центра.
Так, электронодонорные заместители
(+I-, +М-эффект) увеличивают
электронную плотность в бензольном
ядре, что приводит к росту реакционной
способности субстрата; такие заместители
ориентируют электрофил в реакциях
оказывает влияние структура субстрата,
т. е. окружение реакционного центра.
Так, электронодонорные заместители
(+I-, +М-эффект) увеличивают
электронную плотность в бензольном
ядре, что приводит к росту реакционной
способности субстрата; такие заместители
ориентируют электрофил в реакциях
![]() в орто-, пара-положение (орто-
и пара - ориентанты, или ориентанты
первого рода). Электроноакцепторные
заместители (-М-эффект), напротив,
снижают электронную плотность в
бензольном кольце, что приводит к
снижению реакционной способности
реакционного центра субстрата; такие
заместители ориентируют электрофил в
мета - положение (мета-ориентанты,
или ориентанты второго рода).
в орто-, пара-положение (орто-
и пара - ориентанты, или ориентанты
первого рода). Электроноакцепторные
заместители (-М-эффект), напротив,
снижают электронную плотность в
бензольном кольце, что приводит к
снижению реакционной способности
реакционного центра субстрата; такие
заместители ориентируют электрофил в
мета - положение (мета-ориентанты,
или ориентанты второго рода).
