
- •Лабораторная работа № 1 техника лабораторных работ
- •1. Порядок работы в лаборатории
- •2. Обязательные требования к технике безопасности при работе студентов в химической лаборатории
- •3. Правила оказания первой медицинской помощи
- •4. Химическая посуда и обращение с нею
- •5. Мытье и сушка посуды
- •Лабораторная работа № 2 лабораторные нагревательные приборы
- •Лабораторная работа № 3 весы и взвешивание
- •Фильтрование
- •Лабораторная работа № 4 получение оксидов, кислот, оснований, солей
- •1. Получение нерастворимых оснований.
- •2. Получение оксидов.
- •3. Получение кислоты.
- •4. Получение средней соли.
- •Лабораторная работа № 5 общие приемы работы с газами
- •Лабораторная работа № 6 определение относительной молекулярной массы оксида углерода (IV)
- •Лабораторная работа № 7 определение эквивалентной массы магния методом вытеснения
Лабораторная работа № 6 определение относительной молекулярной массы оксида углерода (IV)
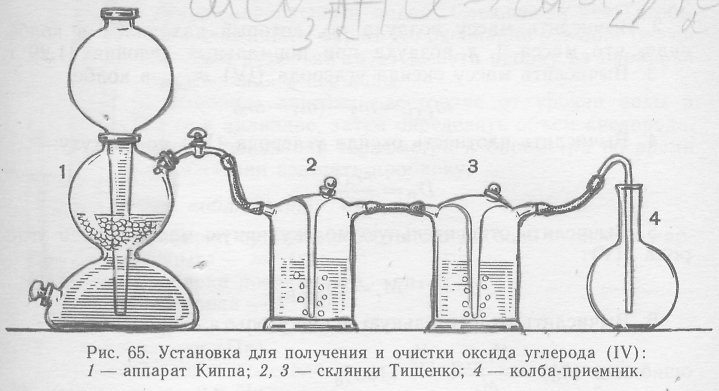
Приборы и посуда. 1) Установка для получения оксида углерода (IV) (рис. 65). 2) Прибор для получения кислорода. 3) Мерный цилиндр на 300—500 мл. 4) Барометр. 5) Весы с разновесом. 6) Горелка.
Реактивы и материалы. 1) Бертолетова соль КСlO3. 2) Оксид марганца (IV) МnO2 (прокаленный порошок).
Установка (рис. 65) состоит из аппарата Киппа 1, заряженного кусками мрамора и соляной кислотой, двух последовательно соединенных склянок Тищенко 2 и 3 (склянка 2 заполнена водой для очистки проходящего оксида углерода (IV) от хлороводорода и от механических примесей, склянка 3 — серной кислотой для осушки газа) и колбы 4 емкостью 250 мл для собирания оксида углерода (IV).
Вымыть и высушить колбу. Подобрать к ней пробку и отметить уровень, до которого входит пробка в горло колбы (надеть на горло колбы резиновое кольцо или сделать метку карандашом по стеклу). Взвесить колбу с пробкой с точностью до 0,01 г. Данные записать.
Наполнить колбу оксидом углерода (IV), опустив газоотводную трубку до дна колбы. Закрыть колбу пробкой (пробка должна входить на ту же глубину, что и при взвешивании колбы) и вновь взвесить. Чтобы быть уверенным в том, что воздух из колбы полностью вытеснен и она целиком наполнена оксидом углерода (IV), надо, взвесив колбу, еще раз на несколько минут опустить в нее газоотводную трубку, пропустить газ и вновь взвесить колбу, повторяя эту операцию до получения постоянной массы колбы с газом. Значение массы колбы с оксидом углерода (IV) записать.
Определить объем колбы, наполнив ее водой до пробки, измерить затем объем воды мерным цилиндром и записать результаты. Отметить и записать показания термометра и барометра во время опыта.
Форма записи наблюдений
1. Масса колбы (с пробкой) с воздухом — m1 (г).
2. Масса колбы (с пробкой) с оксидом углерода (IV) — m2 (г).
3. Объем колбы— V (мл).
4. Температура — t (°С).
5. Давление — р (кПа).
Обработка результатов
1. Объем воздуха в колбе V привести к нормальным условиям (T0=273К, р0= 101,3 кПа) по формуле
![]()
где V — объем колбы, р — атмосферное давление, Т — температура комнаты в Кельвинах (ро— 101,3 кПа, Т0 — 273 К).
2. Вычислить массу воздуха m3, который находился в колбе, зная, что масса 1 л воздуха при нормальных условиях 1,29 г.
3. Вычислить массу оксида углерода (IV) mCO2 в колбе:
![]()
4. Вычислить плотность оксида углерода (IV) по воздуху:
![]()
![]()

Лабораторная работа № 7 определение эквивалентной массы магния методом вытеснения
Приборы и посуда. 1) Весы с разновесом. 2) Прибор (рис. 57) для определения эквивалентной массы (штатив с кольцом и лапкой, бюретка емкостью 50 мл, пробирка, две пробки с газоотводными трубками, воронка, резиновые трубки). 3) Барометр. 4) Термометр (комнатный). 5) Штатив с кольцом. 6) Горелка. 7) Эксикатор. 8) Фарфоровые тигли (2 шт.). 9) Воронка. 10) Бюкс. 11) Щипцы тигельные. 12) Нож. 13) Асбестовая сетка.
Реактивы и материалы. Магний (лента).
Растворы. 1) Азотная кислота HNO3 (4 н.). 2) Серная кислота HSO4 (2 н.).
Собрать прибор по рисунку 64. Прибор, состоящий из бюретки 1 (емкостью 50 мл), соединенной посредством резиновых трубок с воронкой 2 и пробиркой 3, укрепить в штативе. Бюретку и пробирку плотно закрыть пробками, через которые проходят стеклянные трубки.
Перед началом опыта проверить прибор на герметичность (см. подпись под рис. 64).
Проведение опыта
Взвесить кусочек ленты магния около 0,03 г. Вынуть пробку из пробирки и передвижением воронки установить уровень воды в бюретке на нулевом делении или немного ниже.
Отмерить 5 мл разбавленной серной кислоты и влить в пробирку через воронку (почему?). Положить ленту магния на сухую стенку пробирки так, чтобы магний не соприкасался с серной кислотой. Присоединить пробирку к прибору, плотно закрыв ее пробкой. Затем передвижением воронки привести воду в бюретке и в воронке к одинаковому уровню (зачем?). Отметить и записать уровень воды в бюретке, произведя отсчет по нижнему мениску жидкости с точностью до 0,1 мл.
Стряхнуть магний в серную кислоту. Что происходит?
По окончании реакции дать пробирке остыть до комнатной температуры, после чего снова привести воду в бюретке и воронке к одинаковому уровню, отметить и записать уровень воды в бюретке.
Отметить и записать показания комнатного термометра и барометра (1 мм рт. ст. = 133,3 Па) во время опыта.
Форма записи наблюдений
-
Масса магния — m (г). (г).
-
Температура — t° (С).
-
Атмосферное давление — р (кПа).
-
Давление насыщенного водяного пара (табл. 1) —h (кПа).
-
Уровень воды в бюретке до реакции — a1 (мл).
-
Уровень воды в бюретке после реакции — а2 (мл).
Обработка результатов
-
Вычислить объем водорода (в мл), вытесненного магнием при температуре t и давлении р.
-
Вычислить парциальное давление водорода: рH2 = pатм — h.
-
Привести найденный объем водорода к нормальным условиям, используя объединенное уравнение газового состояния. Следует учесть, что водород собран над водой, поэтому в уравнение вместо р следует поставить рH2.
-
Вычислить массу выделившегося водорода.
-
Рассчитать эквивалентную массу магния.
-
Определить абсолютную и относительную ошибку опыта.
