
5. Классификация комплексных соединений
а) Неэлектролиты [Pt(NH3)2Cl2], [Co(NH3)3(NO2)3]
Электролиты – соли, основания, кислоты
[Zn(NH3)4]Cl2; [Zn(NH3)4](OH)2; H4[Fe(CN)6]
б) По природе центрального атома: комплексы s-, p-, d-элементов. d-Элементы наиболее типичные комплексообразователи. Они образуют комплексы как с монодентатными, так и с полидентатными лигандами. Среди комплексов p-элементов есть центральные атомы как металлов, так и неметаллов: K[PF6], K[BiI4].
До середины прошлого века не были известны комплексы s-элементов. В 1946 г. (Шварценбах, Швейцария) были открыты органические вещества, названные комплексонами, способные прочно связывать в комплексы двухзарядные ионы s-элементов Be2+–Ba2+ . Приблизительно на 20 лет позднее начала быстро развиваться химия комплексных соединений с макроциклическими лигандами. Эти лиганды дают прочные комплексы с ионами щелочных металлов, которые вообще не образуют комплексы с обычными лигандами. Отметим, что ионы щелочных металлов часто встречаются в составе комплексных соединений, но они находятся во внешней сфере, не являясь комплексообразователями. Применение макроциклических лигандов изменило представление о ионах щелочных металлов как не способных к комплексообразованию. Итак, все ионы металлов могут быть центральными атомами к комплексах.
в) По природе лигандов
Анионные и молекулярные лиганды. NH3, NO2–
Природа донорного атома: галогены, кислород, сера, азот, фосфор, углерод. Среди перечисленных атомов есть жесткие и мягкие доноры.
Монодентатные лиганды – образующие одну связь: ионы галогенов Х–, CN–, NO2–, S2O32–, NH3, CH3NH2.
Полидентатные лиганды – образующие две или более связей (хелатные комплексы, внутрикомплексные, комплексонаты, комплексы с макроциклическими лигандами).
К полидентатным лигандам относятся полиамины (NH2CH2CH2NH2), Ионы многоосновных карбоновых кислот (оксалат C2O42–, цитрат С6Н5О73–), ионы аминокислот. Простейший пример комплекса с ионом аминокислоты – глицинат меди [Cu(NH2CH2COO)2]. Такого типа соединения называют внутрикомплексными. Подразумевается, что когласно химической формуле это обычная соль. Однако отсутствие диссоциации в растворе означает, что это комплексное соединение.
Широкое применение получили комплексы с более сложными аминокислотами, называемые комплексонами. К их числу относится этилендиаминтетрауксусная кислота. Ее анион – этилендиаминтетраацетат
(–O2CCH2)2NH2CH2CH2NH2(CH2CO2–)2, образует с ионами металлов до 6 связей через азот и кислород.
В 70-х годах прошлого столетия началось бурное развитие химии макроциклических комплексов. Можно назвать несколько типичных разновидностей макроциклических молекул:
–
.. .. ..
.. ..
О
.. .. ..
.. ..
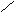





О СН2СН2ОСН2СН2ОСН2СН2ОСН2СН2О
СН2СН2ОСН2СН2ОСН2СН2ОСН2СН2О
– циклические пептиды. Донорные атомы – кислород карбонильных групп
– циклические полиамины;
– производные порфина – макроцикла с четырьмя донорными атомами азота и ароматическим комплектом π-электронов (молекула плоская)

Это родоначальная структура многих природных соединений. Так в гемоглобине железо комплексуется в центре протопорфирина, отличающегося наличием радикалов, замещающих некоторые атомы водорода у атомов углерода. В других соединениях в прогалине макроцикла связаны магний, кобальт и, возможно, другие атомы металлов. В случае железа, имеющего КЧ 6, остаются свободными 2 координационных положения. Одна связь образуется с азотом белка в радикале гистидина. Этой связью макроцикл присоединяется к белку глобину. По оставшейся связи обратимо присоединяется кислород. В похожих комплексах, являющихся ферментами, образуются две связи с белком. Получаются изумительные по прочности и функциональным свойствам молекулярные конструкции.
Дальнейшим развитием идеи макроциклов являются криптанды – молекулы, имеющие внутри уже не прогалину, а полость. Ограничимся одним примером. В молекуле криптанда между двумя атомами азота имеются 3 цепочки из групп С2Н4 и атомов кислорода. Цепочки создают полость, в которой связываются ионы металлов.

В криптандах можно целенаправленно изменять число и природу донорных атомов. Например, на место жестких атомов кислорода можно вводить мягкие атомы серы. Так формируется избирательность к комплексованию металлов разной природы.
