
3. Изомерия комплексных соединений
В комплексных соединениях часто встречается явление изомерии. Это сближает их с органическими соединениями. Известно несколько разновидностей изомерии. Их можно объединить в две группы: структурная изомерия и пространственная изомерия.
К разновидностям структурной изомерии относятся:
– ионизационная и гидратная изомерия – разное размещение молекул воды и др. лигандов между внутренней и внешней сферой: [Cr(H2O)5Cl]Cl2·H2O и [Cr(H2O)4Cl2]Cl·2H2O; [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2.
– координационная изомерия; сущность ясна из примера: [Pt(NH3)4][PdCl4] и [Pd (NH3)4][PtCl4]
– связевая изомерия. Например, группа NO2– может быть связана с центральным атомом как через кислород, так и через азот: [Co(NH3)5NO2]Cl2 и [Co(NH3)5ONO]Cl2.
Разновидности пространственной изомерии.
Цис-транс-изомерия. Встречается в квадратных и октаэдрических комплексах. Особенно интересный пример – изомеры дихлордиамминплатины:
C


 l
NH3
Cl NH3
l
NH3
Cl NH3



 Pt
Pt
Pt
Pt
Cl NH3 H3N Cl
цис-изомер транс-изомер
Цис-изомер оказался эффективным противоопухолевым средством, в то время как у транс-изомера подобного действия нет.
В октаэдрических комплексах возможна так же энантиомерия.
4. Природа химических связей в комплексных соединениях
Существование комплексных соединений возможно потому, что атомы металлов проявляют способность к образованию дополнительных связей, не предусмотренных классическими представлениями о валентности.
В результате разработки квантовой теории валентности природа связей в комплексных соединениях стала в принципе понятна. Ионы металлов имеют достаточное число свободных орбиталей для того, чтобы выступать в роли акцепторов электронных пар. Ионы и молекулы, состоящие из атомов неметаллов, могут быть донорами электронных пар. Образование некоторого числа донорно-акцепторных связей, превышающего валентность металла, становится понятным. Но в задачи теории входит и количественная характеристика прочности связей, объяснение спектральных свойств, то есть окраски соединений, а также магнитных свойств.
Комплексные соединения можно условно разделить на две главные разновидности: комплексы с преимущественно ионной связью M – L, и комплексы с преимущественно ковалентной связью.
Обычно считается, что ионная связь в водном растворе подвергается полной диссоциации. Однако известны исключения. Ион фтора F–, более жесткий, чем молекулы воды, способен в растворе конкурировать с водой за образование связей с катионами. Он вытесняет воду из ближайшего окружения жестких ионов металлов, образуя ионные комплексы. Подобным образом ведут себя и некоторые кислородсодержащие анионы, например, фосфат. К жестким катионам относятся ионы d-элементов 4-го периода в степени окисления +2 и выше. С ними и образуются ионные комплексы: [FeF6]3– , [Fe(HPO4)3]3–.
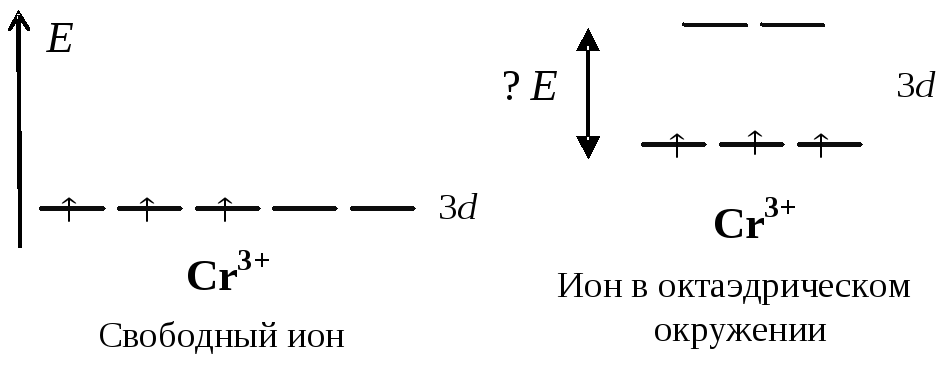
Более многочисленны комплексные соединения с настоящими донорно-акцепторными связями. К ним часто применяют понятия теории Льюиса: центральный атом – кислота, лиганды – основания. Для объяснения наблюдаемых координационных чисел ионов d-элементов следует рассматривать заселенность электронами d-подуровня. Рассмотрим электронную структуру ионов Cr3+ и Zn2+, образующих много устойчивых комплексных соединений с координационными числами 6 у хрома и 4 у цинка.

На диаграммах видим, что для образования связей с лигандами у Cr3+ 6 свободных орбиталей, а у Zn2+ 4 орбитали. Координационные числа 6 у хрома и 4 у цинка становятся понятными. Валентные электроны на орбиталях 3d-подуровеня остаются несвязывающими. В некоторых других случаях для объяснения наблюдаемых КЧ приходится привлекать дополнительные представления. Например, у железа(0) в карбонильном комплексе КЧ 5. Лиганды СО образуют настолько прочные связи с атомом железа, что оказывается возможным переход всех валентных электронов на 3d-подуровень в спаренной конфигурации.

Для образования донорно-акцепторных связей остаются 5 орбиталей. Координационное число равно 5.
Комплексы d-элементов имеют разнообразную окраску, которая связана с заселенностью электронами d-подуровня. Пять d-орбиталей имеют одинаковую энергию в свободном атоме. Если атом или ион окружен лигандами, то под действием электрического поля лигандов энергия орбиталей d-подуровня повышается, и подуровень расщепляется на группы орбиталей с разной энергией. Рассмотрим это на примере октаэдрического комплекса. В результате расщепления у трех из пяти орбиталей, обозначаемых dxy, dxz, dyz, энергия оказывается ниже, а у двух оставшихся dx2-y2 и dz2 – выше. Поглощая кванты излучения в видимой области, электрон переходят с нижнего подуровня на верхний. Это и приводит к возникновению окраски.
В зависимости от силы поля лигандов величина ΔЕ изменяется, что влечет за собой и изменение окраски. Комплексы хрома(III) окрашены в различные оттенки от желтого до зеленого. У некоторых ионов d-элементов (Cu+1, Zn+2, Ag+1) на d-орбиталях 10 электронов. У таких ионов переходы между d-орбиталями невозможны, и окраска не возникает. Эти комплексы в растворах бесцветны.
Наличие не спаренных электронов обусловливает парамагнитные свойства комплексов. При отсутствии не спаренных электронов комплексы диамагнитны. Возьмем железо(II) в качестве комплексообразователя. На d-орбиталях находятся 6 электронов. В октаэдрическом комплексе с сильным полем лигандов происходит сильное расщепление, и все электроны заселяют 3 нижние орбитали. Тогда комплексы диамагнитны. При слабом поле лигандов расщепление небольшое, и начинает действовать правило Хунда. Два электрона переходят на верхний подуровень, и получается парамагнитный комплекс.
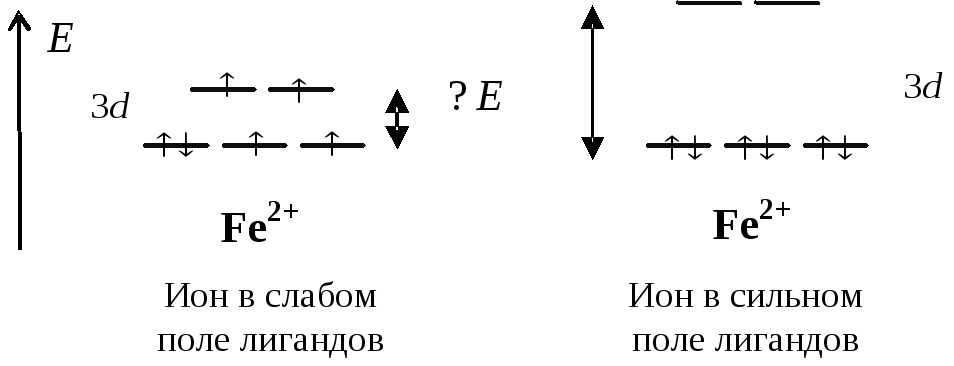
Можно дать следующий приблизительный ряд лигандов по возрастанию силы поля:
I– < Br– < Cl– < F– < H2O< NH3 < NH2(CH2)2NH2 < NO2– < CN–
С участием d-орбиталей возникают дополнительные виды гибридизации орбиталей, определяющие пространственное размещение лигандов вокруг центрального атома.
Таблица 16.1. Типичные виды гибридизации с участием d-орбиталей.
|
Набор орбиталей |
Пространственная направленность |
|
(n-1)d2ns1np3 |
Октаэдр |
|
(n-1)d1ns1np2 |
Квадрат |
|
(n-1)d1ns1np3 |
Тригональная бипирамида |
Устойчивость комплексных соединений определяется не только энергией донорно-акцепторных связей, но и, в ряде случаев, образованием кратных связей M – L. К числу наиболее прочных комплексных соединений принадлежат цианидные комплекы. Группа CN–, как мы знаем, образует связь через электронную пару углерода. Из наличия π-связей между атомами углерода и азота вытекает и наличие свободных разрыхляющих орбиталей цианогруппы (такие орбитали рассматриваются в методе молекулярных орбиталей, у нас это элективная тема). На разрыхляющие орбитали могут передаваться электронные пары с d-орбиталей центрального атома. Связи такого типа называют π-дативными. В результате обратного (по отношению к донорно-акцепторной σ-связи) переноса электронной пары от металла к лиганду связь с лигандом становится двойной, и достигается равномерное распределение электронной плотности между атомами. На рис. представлено образование донорно-акцепторной σ-связи и дативной π-связи атома железа с цианогруппой. Прочность этих связей проявляется в высокой устойчивости комплексов, в частности, K4[Fe(CN)6] и K3[Fe(CN)6].

