
Лекция 13 Комплексные (координационные) соединения
Предлагаю сначала посмотреть опыт, показывающий влияние количественного соотношения исходных веществ на образование разных продуктов реакции. При смешивании нитрата серебра с избытком тиосульфата натрия образовалось растворимое в воде, бесцветное и устойчивое комплексное соединение:
AgNO3 + 2Na2S2O3 = Na5[Ag(S2O3)3] + NaNO3
Вы разочарованы отсутствием впечатляющих изменений. Зато при смешивании небольшого объема раствора тиосульфата натрия с избытком нитрата серебра промелькнул непрерывный ряд цветовых изменений возникшей взвеси, и процесс закончился на образовании черной взвеси сульфида серебра:
2
белый
A
черный
Промежуточные цвета явились следствием укрупнения наночастиц взвеси. Опыт показал одно из характерных следствий комплексообразования – стабилизацию неустойчивых частиц. В тиосульфате серебра дестабилизирующее действие двух ионов серебра направлено на один тиосульфат-ион. А в образующемся комплексном ионе тритиосульфатоаргентат(I)-ионе дестабилизирующее действие одного иона серебра распыляется на 3 тиосульфат-иона.
От опыта перейдем к теории.
1. Какие соединения называются комплексными (координационными). Прежде всего, выясним, какое место отведено комплексным соединениям в химии, как их воспринимать? Это самая многочисленная разновидность неорганических соединений, так как при усложнении состава вещества (это следует из проделанного опыта) появляется возможность для множества новых сочетаний атомов, которых не может быть в обычных солях, кислотах и основаниях. Но это не единственная причина многочисленности комплексных соединений. В этих соединениях неорганические вещества перечисленных (да и некоторых других) классов могут быть соединены с необозримым числом органических веществ – кислородсодержащих, азотсодержащих, серосодержащих и даже углеводородов.
Нельзя сказать, что комплексные соединения так сложны, что их невозможно охватить на начальном уровне изучения химии. Например, в школе изучают такие сложные вещества, как белки. Если молекула белка присоединила ион цинка или кальция, то сложность вещества повысилась незначительно. А ведь то, что образовалось из белка и иона металла – это комплексное соединение. Стоит обратить внимание на то, что комплексные соединения неорганических веществ с органическими – это связующее звено между неорганической и органической химией.
Существенная особенность комплексных соединений состоит в том, что их можно и мысленно, и реально разделить на две, а иногда и более, составные части, способные существовать как устойчивые сложные вещества. Само слово комплекс переводится с латинского как связь, сочетание.
В природе комплексные соединения встречаются среди минералов (криолит Na3[AlF6]), но особенно много их в живой природе. Здесь обнаружены уникальные по своим свойствам комплексы гемоглобин и миоглобин (белки, соединенные с гемом, содержащим ионы железа), цитохромы (то же самое), хлорофилл (белок и магний), белки, связывающие ионы кальция, и много других.
Комплексные соединения нельзя считать особым классом веществ – они могут быть и солями, и кислотами, и основаниями, и веществами с молекулярной структурой, подобно органическим веществам. Они рассматриваются в качестве особой разновидности химических соединений с учетом особенностей их состава и структуры. Главным признаком комплексных соединений является наличие акцепторного центрального атома, окруженного некоторым числом донорных атомов, причем число окружающих атомов (координационное число, КЧ) превышает валентность (степень окисления) центрального атома.
Следует заметить, что координационное число атома может превышать валентность не только в комплексных соединениях. Например, в кристаллах хлорида железа(III) FeCl3 каждый атом железа связан с шестью атомами хлора, а последние, в свою очередь, являются мостиками между атомами железа:
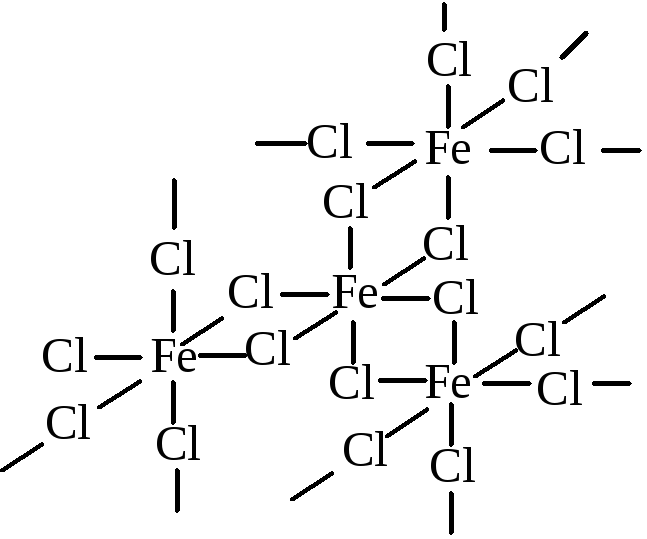
Поэтому трехвалентное железо в этом веществе имеет координационное число 6. Однако в формуле FeCl3 число атомов хлора совпадает с валентностью железа. Такую формулу невозможно мысленно разбить на две формулы сложных веществ. Хлорид железа(III) это обычная соль. С учетом всего сказанного, можно дать такое определение:
Комплексные соединения – это вещества, в формулах которых число атомов, образовавших связи с центральным атомом, превышает валентность этого атома.
В большинстве молекул, начиная с трехатомных, можно выделить атом, занимающий центральное положение: углерод в СО2 и в СН4, сера в сульфат-ионе, фосфор в фосфорной кислоте и т.д. Но это обычные, не комплексные соединения, так как в них координационное число не превышает валентность. Комплексные соединения распознаются по их формулам. Рассмотрим следующие формулы:
CCl4, SiF4, Na2SO4, FeCl3, [Cu(NH3)4]SO4, K2[SiF6], [Fe(CO)5].
Первые 2 вещества с молекулярным строением. Углерод и кремний имеют КЧ 4 и четырехвалентны. В третьем веществе сульфат-ион имеет координационное строение с атомом серы(VI) в центре. При этом КЧ 4 меньше валентности серы. Сульфаты и подобные им фосфаты, перхлораты и др. рассматриваются как обычные соли, но у них есть сходство с комплексными соединениями. В четвертом веществе с ковалентной структурой железо трехвалентно, но его КЧ 6. Это обычная соль, так как число атомов хлора равно валентности железа. В следующем веществе в каждой структурной единице на атом двухвалентной меди приходится 4 молекулы аммиака. Далее, в гексафторосиликате калия на один атом Si шесть атомов F. Оба соединения комплексные. Последнее вещество – это пример проявления необычных валентностей в комплексных соединениях. Железо с валентностью 0 (все его электроны спарены) образует 5 донорно-акцепторных связей с молекулами оксида углерода(II). Здесь у железа КЧ 5 при валентности 0! Это вещество – пример довольно странного типа комплексных соединений, называемых карбонилами.
2
+4
1
Составные части комплексного соединения имеют особые названия. Часть формулы, заключенная в квадратные скобки, составляет внутреннюю сферу комплексного соединения, или комплексную частицу. В устойчивых комплексных соединениях комплексная частица переходит в раствор как единое целое. Часть формулы за квадратными скобками называется внешней сферой комплексного соединения. Это катионы или анионы, компенсирующие электрический заряд внутренней сферы. Между внешней и внутренней сферой комплекса имеется связь ионного типа.
Внутренняя сфера комплекса может иметь как отрицательный, так и положительный заряд, в зависимости от суммы зарядов центрального атома и связанных с ним частиц. Это можно уяснить на примерах веществ, приведенных в таблице. Если с металлом связаны одновременно анионы и молекулы, то комплексная частица может оказаться не заряженной. В этом случае комплекс не имеет внешней сферы, и представляет собой молекулу: [Co(NH3)3(NO2)3], [Pt(NH3)2Cl2]. При определении заряда комплексной частицы применяется правило: заряд равен алгебраической сумме степени окисления центрального атома и зарядов частиц, связанных с ним. Если заряд внутренней сферы известен, то по этому правилу можно вычислить степень окисления центрального атома.
Структура комплексных соединений
|
|
K3[Fe(CN)6], комплексный анион |
[Pt(NH3)2Cl2] молекула |
[Zn(СН3NH2)4]SO4 комплексный катион |
|
Центр атом |
Fe3+ |
Pt2+ |
Zn2+ |
|
СО, |
+3, |
+2, |
+2, |
|
КЧ |
6 |
4 |
4 |
|
Лиганды |
:CN– |
:NH3, :Cl– |
:СН3NH2 |
|
Ионы внешней сферы |
K+ |
нет |
SO42– |
|
Координационный многогранник |
октаэдр |
квадрат |
тетраэдр |
Сердцевиной внутренней сферы комплексного соединения является центральный атом. В большинстве комплексов это атом металла в положительной степени окисления. В более редких случаях возможна и степень окисления 0, и даже отрицательная степень окисления. В относительно небольшом числе комплексных соединений центральным атомом может быть неметалл: B, Si, P и др. неметаллы III – V групп.
Ионы (как правило, анионы) и молекулы, непосредственно связанные с центральным атомом во внутренней сфере комплекса, называются лигандами. В составе лиганда должны быть атомы, имеющие валентные электронные пары, с помощью которых образуются донорно-акцепторные связи с центральным атомом. Таких ионов и молекул очень много. Легче было бы перечислить молекулы, не способные выступать в роли лигандов. Как пример, можно назвать предельные углеводороды. В их молекулах нет свободных валентных электронных пар. Но карбоанионы, например СН3–, могут входить в состав комплексов в качестве лигандов.
Атом лиганда, образующий донорно-акцептор-ную связь с центральным атомом, называется донорным атомом.
