
- •Основные понятия, законы, формулы
- •Из опытных законов (любых двух) для идеальных газов вытекает объединенный газовый закон (уравнение Клапейрона):
- •Примеры решения задач
- •Кроме того, при равновесии столбика ртути должно быть
- •Литература
- •Преженцев Михаил Дмитриевич
- •Молекулярная физика и термодинамика
Примеры решения задач
В данной контрольной работе рассматриваются задачи на темы:
1. Нахождение концентрации молекул газа.
2. Уравнение Клапейрона-Менделеева.
3. Нахождение кинетической энергии молекул.
4. Нахождение теплоемкости газов.
5. Первое начало термодинамики.
6. Цикл Карно.
7. Изменение энтропии.
8. Поверхностное натяжение и капиллярные явления.
Пример 1. Определить: 1) число атомов, содержащихся в 1 кг гелия; 2) массу одного атома гелия.
Р е ш е н и е. 1. Число молекул в данной массе газа
![]() ,
,
где m – масса газа;
М – молярная масса;
ν = m/M – количество вещества,
NА – постоянная Авагадро.
Поскольку молекулы гелия одноатомны, число атомов в данной массе газа равно числу молекул.
Запишем величины, входящие в формулу , в СИ: М = 4 ∙ 10-3 кг/моль, NA = 6.02 ∙ 1023 моль-1.
Найдем искомое число атомов:
![]() .
.
2. Для определения массы mi одного атома массу газа разделим на число атомов в нем:
![]() ,
,
подставив числовые значения величин в (2), получим
![]()
Пример 2. В баллоне объемом 10 л находится гелий под давлением p1 = 1 МПа и при температуре Т1 = 300 К. После того как из баллона было взято m = 10 г гелия, температура в баллоне понизилась до Т2 = 290 К. Определить давление p2 гелия, оставшегося в баллоне.
Р е ш е н и е. Для решения задачи воспользуемся уравнением Менделеева-
Клапейрона, применив его к конечному состоянию газа:
![]() ,
(1)
,
(1)
где m2 – масса гелия в баллоне в конечном состоянии;
М – молярная масса гелия;
R – молярная газовая постоянная.
Из записанного уравнения выразим искомое давление:
![]() .
(2)
.
(2)
Массу m2 гелия выразим через массу m1, соответствующую начальному состоянию, и массу m гелия, взятого из баллона:
m2 = m1 – m . (3)
Массу m1 гелия найдем также из уравнения Менделеева-Клапейрона, применив его к начальному состоянию:
![]() .
(4)
.
(4)
Подставив выражение массы m1 в (3), а затем выражение m2 в (2), найдем
![]()
или
![]() (5)
(5)
Проверим, дает ли формула (5) единицу давления. Для этого в ее правую часть вместо символов величин подставим их единицы. В правой части формулы два слагаемых. Очевидно, что первое из них дает единицу давления, так как состоит из двух множителей, первый из которых (Т2/Т1) – безразмерный, а второй – давление. Проверим второе слагаемое:
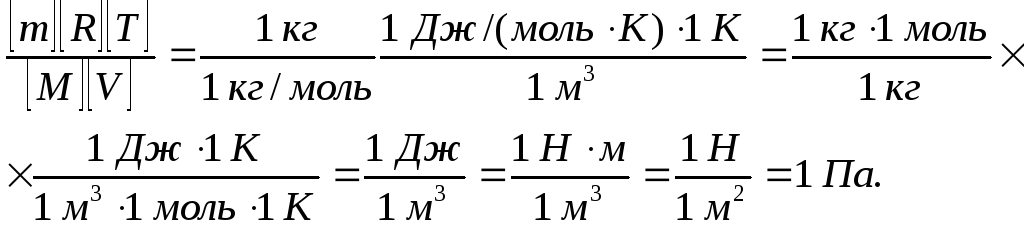
Паскаль является единицей давления. Произведем вычисления по формуле (5), учитывая, что М = 4 ∙ 10-3 кг/моль:
![]()
Пример 3. Баллон содержит m1 = 80 г кислорода и m2 = 320 г аргона. Давление смеси p = 1 Мпа, температура Т = 300 К. принимая данные газы за идеальный определить объем V баллона.
Р е ш е н и е. По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. По уравнению Менделеева-Клапейрона, парциальные давления p1 кислорода и p2 аргона выражаются формулами
![]()
![]()
Следовательно, по закону Дальтона, давление смеси газов
![]()
откуда объем баллона равен
![]()
Произведем вычисления, учитывая, что М1 = 32 · 10-3 кг/моль, М2 = 40 · 10-3 кг/моль:
![]()
![]() Пример
4. Посередине
откачанной и запаянной с обоих концов
горизонтальной трубки находится столбик
ртути длиной h
= 19,6 мм. Если трубку поставить под углом
α
= 300
к горизонту, то столбик ртути переместится
на Δℓ1
= 20 мм; если поставить вертикально – на
Δℓ2
= 30 мм. До
какого давления откачен воздух из
трубки?
Пример
4. Посередине
откачанной и запаянной с обоих концов
горизонтальной трубки находится столбик
ртути длиной h
= 19,6 мм. Если трубку поставить под углом
α
= 300
к горизонту, то столбик ртути переместится
на Δℓ1
= 20 мм; если поставить вертикально – на
Δℓ2
= 30 мм. До
какого давления откачен воздух из
трубки?
Р е ш е н и е. В задаче говорится о трех
состояниях двух газов одинаковой массы,
разделенных столбом ртути (рис. 1). В
процессе перемещения трубки из
горизонтального положения в вертикальное
вследствие смещения столбика ртути
газ, находящийся в правой части трубки,
будет расширяться, а в левой – сжиматься.
е ш е н и е. В задаче говорится о трех
состояниях двух газов одинаковой массы,
разделенных столбом ртути (рис. 1). В
процессе перемещения трубки из
горизонтального положения в вертикальное
вследствие смещения столбика ртути
газ, находящийся в правой части трубки,
будет расширяться, а в левой – сжиматься.
Рис.1
Так как по условию задачи масса и температура не меняются, то для каждой пары состояний каждого газа должно иметь место уравнение закона Бойля - Мариотта. Совокупность этих уравнений полностью характеризует изотермический процесс, описываемый в данной задаче.
Состояние газа при горизонтальном положении трубки примем за первое состояние. Вторым будем считать состояние газа в наклонной трубке, третьим – состояние газа при вертикальном положении трубки.
Обозначим давление газа в левой части трубки в каждом из этих состояний через р1, р2, р3, длину столбов воздуха через ℓ1, ℓ2, ℓ3, тогда, применяя закон Бойля-Мариотта для каждой пары состояний и учитывая, что площадь поперечного сечения трубки всюду одинакова, получим:
р1ℓ1 = р2ℓ2; р1ℓ1 = р3ℓ3.
Аналогично для газа, заключенного в правой части трубки:
р1ℓ1 = р΄2ℓ΄2; р1ℓ1 = р΄3ℓ΄3,
так как в первом состоянии давления и объемы газа в обеих частях трубки были одинаковы.
Если при отклонении трубки от горизонтального положения на угол α столбик ртути сместился на расстояние Δℓ1, при отклонении на угол 90˚ - на расстояние Δℓ2, то как видно из чертежа,
ℓ2 = ℓ1 - Δℓ1; ℓ3 = ℓ1 - Δℓ2;
ℓ΄2 = ℓ1 + Δℓ1; ℓ΄3 = ℓ1 + Δℓ2.
