
Определение длины волны с помощью дифракционной решетки
1. Цель работы: ознакомление с дифракцией световых волн на дифракционной решетке, определение длины волны.
2


 .
Теоретические основы: Дифракционная
решетка - периодическая структура,
состоящая из большого числа одинаковых
параллельных щелей, равноудаленных
друг от d
.
Теоретические основы: Дифракционная
решетка - периодическая структура,
состоящая из большого числа одинаковых
параллельных щелей, равноудаленных
друг от d
р












 ешетки
d=a+b,
b
–
ширина щели, а
–
ширина перегородки.
ешетки
d=a+b,
b
–
ширина щели, а
–
ширина перегородки.


 Направим
на решетку монохроматический пучок
b
а
Направим
на решетку монохроматический пучок
b
а
параллельных лучей, падающих перпендикулярно решетке.
Согласно принципу Гюйгенса-Френеля, каждую щель можно Рис.10
рассматривать как источник вторичных волн. Для произвольного
направления, характеризующегося углом , разность хода двух соседних лучей (рис.10)
![]() (7.1)
(7.1)
Поскольку все щели находятся друг от друга на одинаковом расстоянии, то разности хода лучей, идущих от двух соседних щелей будут одинаковы для всей дифракционной решетки. Максимумы наблюдаются в тех направлениях, для которых разность хода равна целому числу длин волн,т.е.
![]() (7.2)
(7.2)
Используя формулу (7.2) можно определить длину волны монохроматического излучения, предварительно определив углы , для максимумов соответствующих порядков:
![]() .
(7.3)
.
(7.3)
3. Экспериментальная часть
3.1. Краткое описание экспериментальной установки и оборудования
Установка собирается на оптической скамье. Схема установки представлена на рис.11.
n λкр экран



х xn




 n
–
расстояние между максимумами
n
–
расстояние между максимумами
лазер
L

 n
- направление
на максимум
n-го
порядка
n
- направление
на максимум
n-го
порядка
Рис.11
3.2. Методика проведения эксперимента
3.2.1. Включить лазер. (Выполняется лаборантом).
3.2.2. Установить экран и дифракционную решетку строго перпендикулярно оптической оси лазера.
3.2.3. Измерить расстояние L между плоскостью решетки и экраном
3.2.4. Не изменяя L измерить хn – расстояния между соответствующими дифракционными максимумами, начиная с первого порядка. Результаты занести в таблицу.
|
L, м |
n |
xn |
tg n |
n |
sin n |
, м |
, м |
|
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
Средние значения |
|
|
|||||
3.3. Обработка результатов измерений
3.3.1. По результатам измерений L и хn определить соответствующие углы (см.рис.11).
![]() .
.
3.3.2. По формуле (7.3) определить длину волны для каждого из углов. Результаты занести в таблицу.
3.3.3. Рассчитать средние значения и определить погрешность измерений.
4.Контрольное задание
1.Ознакомиться с материалом лекции и решить домашние контрольные задачи на эту тему.
2.Сформулировать принцип Гюйгенса-Френеля.
3. Зная постоянную решетки и длину волны, определить число максимумов для данной решетки.
ЛАБОРАТОРНАЯ РАБОТА №5-01
иссследование видимой части излучения атома водорода и определение постоянной ридберга
Цели работы:
-
определение постоянной Ридберга для спектра излучения атомарного водорода.
ОБЩАЯ ТЕОРИЯ
Исследования английского физика Э. Резерфорда (1911г.) установили так называемую планетарную модель строения атома. Согласно этой модели весь положительный заряд и почти вся масса атома (> 99.94%) сосредоточены в атомном ядре, размер которого ничтожно мал (10-15м) по сравнению с размером атома (10-10м). Вокруг ядра по замкнутым круговым орбитам движутся электроны, образуя электронную оболочку атома.
Заряд ядра равен по абсолютному значению суммарному заряду электронов и может быть найден по формуле:
q = Ze, (501.1)
где е = 1.6×10-19Кл –– элементарный заряд, Z –– порядковый номер элемента в периодической системе Д.И. Менделеева.
Однако эта модель не укладывалась в рамки законов классической физики, согласно которым, электрон, двигаясь равноускоренно, должен непрерывно излучать (терять) энергию и, в конце концов, упасть на ядро. Атом должен давать сплошной спектр излучения, так как частота вращения электрона по мере приближения к ядру непрерывно изменяется (соответственно, так же меняется и частота излучения).
В действительности атом весьма устойчив и излучает линейчатый спектр, что говорит о том, что частота вращения электрона может принимать лишь определенные значения.
В нашей работе мы будем рассматривать спектр излучения атома водорода, как самого простого вещества.
В видимой части этого спектра обнаружены четыре линии со следующими длинами волн:
-
λк = 0.656мкм –– красная линия;
-
λг = 0.486мкм –– голубая линия;
-
λс = 0.434мкм –– синяя линия;
-
λф = 0.410мкм –– фиолетовая линия.
Швейцарский физик И. Бальмер и шведский физик И. Ридберг установили эмпирическую формулу для определения длин волн этих линий (серия Бальмера):
![]() , (501.2)
, (501.2)
где n = 3, 4, 5, 6,…, R = 1.0974×107м-1 –– постоянная Ридберга, вычисляемая теоретически по формуле:
![]() , (501.3)
, (501.3)
где т, е –– масса и заряд электрона, h = 6.625×10-34Дж∙с–– постоянная Планка,
![]() –– электрическая постоянная,
–– электрическая постоянная,
![]() -
скорость света в вакууме.
-
скорость света в вакууме.
Существуют и другие серии излучений (Лаймана, Пашена и др.), которые к нашему опыту не имеют прямого отношения.
Датский физик Н. Бор (1913г.) усовершенствовал атомную модель Резерфорда и создал другую модель строения атома, в основу которой положил три постулата (постулаты Бора):
-
Электроны могут двигаться в атоме только по орбитам определенного радиуса, на которых момент импульса электрона кратен постоянной Планка
 .
.
Это условие квантования радиуса орбиты выражается формулой:
![]() , (501.4)
, (501.4)
где т –– масса электрона, v –– скорость электрона, r –– радиус орбиты, n = 1,2,3,… –– главное квантовое число.
-
Движение электрона по таким стационарным орбитам не сопровождается излучением (поглощением) энергии.
-
Переход электрона с одной орбиты на другую сопровождается излучением или поглощением кванта энергии:
![]() , (501.5)
, (501.5)
где W1 и W2 –– энергии стационарного состояния атома.
Таким образом, частота излучения определяется разностью энергий, а не частотой вращения электрона в атоме.
В атоме
изотопа водорода
![]() один электрон вращается вокруг одного
протона. Заряды электрона и протона
равны по модулю величине элементарного
заряда е=1,6·10-3 Кл.
один электрон вращается вокруг одного
протона. Заряды электрона и протона
равны по модулю величине элементарного
заряда е=1,6·10-3 Кл.
Пусть электрон вращается по круговой орбите радиуса r, тогда на него будет действовать кулоновская сила, направленная к центру орбиты, которая будет также центростремительной силой. Уравнение движения электрона запишется в виде:
![]() , (501.6)
, (501.6)
откуда
![]() , (501.7)
, (501.7)
где т = 9.11×10-31кг –– масса электрона, ε0 = 8.85×10-12Ф/м –– электрическая постоянная.
Решим совместно уравнения (501.4) и (501.7), исключая скорость. Из (501.4) имеем:
![]() .
.
Подставив скорость в формулу (501.7), получим
![]()
а радиус орбиты электрона равен
![]() . (501.8)
. (501.8)
Полная энергия электрона в атоме есть сумма кинетической энергии и потенциальной энергии притяжения электрона к ядру:
![]() . (501.9)
. (501.9)
Из (501.7) следует, что
![]() ,
,
тогда полная энергия
![]() . (501.10)
. (501.10)
Таким образом, полная энергия электрона отрицательна и равна по модулю его кинетической энергии. Подставляя (501.10) в (501.8), получаем
![]() . (501.11)
. (501.11)
Для ближайшей к ядру орбите (п = 1) полная энергия электрона, находящегося на этой орбите, равна:
 .
.
[1эВ = 1.6×10-19Дж].
Полная энергия электронов в атоме называется энергетическим уровнем атома. На рис. 501-1 схематически изображены уровни энергии атома водорода.

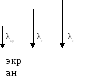
Атом может излучать и поглощать электромагнитные волны только вполне определенных частот (длин волн), чем и обусловлен линейчатый характер водородного спектра.
Серия Бальмера соответствует переходу атома на второй уровень энергии с более высокого. А именно, красная линия соответствует переходу с третьего уровня на второй (п=3 → п=2). При этом частота излучения, согласно (501.5), равна:
![]() [Гц],
[Гц],
а соответствующая длина волны
![]() [м].
[м].
Подставляя константы, получим
![]() .
.
Для переходов с четвертого, пятого и шестого энергетических уровней на второй мы будем иметь в спектре излучения атома водорода длины волн, соответствующие голубому (λгол = 489нм), синему(λсин = 437нм) и фиолетовому(λфио = 414нм) цветам, соответственно. При этом расхождения этих длин волн со значениями, полученными в результате эксперимента, не превышают 0,8%.
