
- •Введение в биоэнергетику Методическая разработка содержание
- •Введение
- •Термодинамика живых систем
- •Макроэргические соединения
- •Энергия и работа живых систем. Этапы преобразования энергии в живом организме
- •Основные этапы преобразования энергии в живом организме
- •Биологическое окисление и процессы энергетического сопряжения
- •Основные этапы биологического окисления.
- •Классификация процессов биологического окисления.
- •Характеристика ферментов дыхательной цепи митохондрий.
- •Механизм сопряжения дыхания и фосфорилирования. Теория окислительного фосфорилирования.
- •Биоэнергетика мышечной деятельности источники энергии при мышечной работе
- •Ресинтез атф в креатинфосфокиназнои реакции
- •Ресинтез атф в процессе гликолиза
- •Ресинтез атф в миокиназной реакции
- •Ресинтез атф в аэробном процессе
- •Литература
Механизм сопряжения дыхания и фосфорилирования. Теория окислительного фосфорилирования.
Для объяснения механизма окислительного фосфорилирования выдвигалось много гипотез.
Общепринятой в настоящее время является хемиосмотическая теория, предложенная Митчеллом в 1961 году.
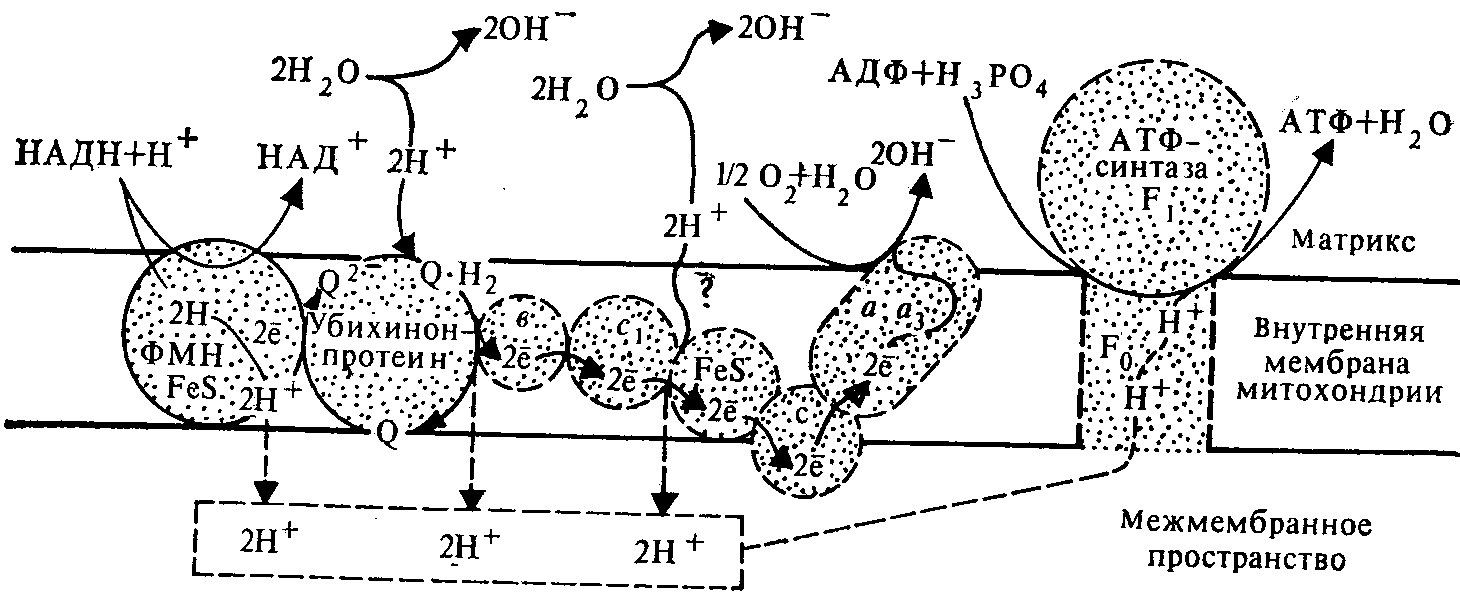
Рис. 3. Схема сопряжения дыхания и фосфорилирования согласно хемиосмотической теории.
1. Процесс протекает на внутренней мембране митохондрий, где располагается дыхательная цепь ферментов.
2. Внутренняя мембрана непроницаема для протонов (и большинства катионов). Это свойство обусловливает возможность неравномерного распределения заряженных частиц по обе стороны мембраны. Движение протонов и электронов имеет строго определенную направленность.
3. Ферменты-переносчики дыхательной цепи располагаются в мембране зигзагообразно. Они способны не только акцептировать атомарный водород от окисляемых субстратов, но и транспортировать его в поперечном направлении через мембрану
Достигая противоположного (внешнего) слоя мембраны, переносчик освобождает в водное пространство снаружи от нее протоны, а электроны при участии дополнительных переносчиков направляются обратно к внутреннему слою мембраны и передаются очередному ферменту дыхательной цепи. Для восстановления ферментам кроме электронов нужны протоны, которые поступают из внутреннего пространства за счет вынужденной диссоциации воды. Всего при переносе пары электронов (от НАД.2Н) по дыхательной цепи происходит выталкивание в межмембранное пространство трех пар протонов.
Таким образом, протоны транспортируются от внутреннего слоя мембраны со стороны матрикса к наружному со стороны межмембранного пространства, а электроны передаются по цепи ферментов, достигая конечного акцептора электронов – кислорода: 2е + ½ О2 + Н2О = 2ОН- (1).
4. В результате такого перераспределения электрических зарядов со стороны матрикса внутренняя мембраны оказывается заряженной отрицательно и щелочной (в ней накапливается избыток ОН- -ионов за счет реакции (1) и остающихся ОН- от диссоциации воды в матриксе), а со стороны межмембранного пространства - заряженной положительно и более кислой (за счет транспорта протонов). Возникает электрохимический протонный градиент, в форме которого на замкнутой мембране и происходит концентрация энергии. Электрохимический потенциал обозначают ΔμН+ и состоит он из электрического (ΔΨ – разности электрических потенциалов) и осмотического (ΔрН – разности концентраций протонов).
ΔμН+ = ΔΨ + ΔрН
Основную величину (4/5) составляет электрический потенциал.
Из-за разницы в концентрации и электрическом потенциале на протоны, находящиеся в наружном пространстве, действует сила, стремящаяся перевести их через мембрану во внутреннее пространство.
5. Возвращение протонов в матрикс осуществляется с помощью фермента аденозинтрифосфатазы (АТФ-азы или АТФ-синтазы). Этот фермент встроен во внутреннюю мембрану. Возникающие изменения в мембране (электрохимический потенциал) передаются АТФ-синтазе, которая активизируется и катализирует синтез АТФ.
АТФ-аза представляет собой интегральный белок, состоящий из двух типов субъединиц: F0 – состоит из четырех полипептидных цепей, проходящих через всю внутреннюю мембрану и образующих канал для протонов; F1 – грибовидная каталитическая субъединица, расположенная на внутренней мембране со стороны матрикса, осуществляют реакцию АТФ + Н2О = АДФ + Н3РО4.
Ток протонов создает в каталитической субъединице электрическое поле, которое смещает реакцию в сторону синтеза АТФ. В матриксе протоны соединяются с гидроксильными ионами. Образуется вода – конечный продукт окислительного фосфорилирования. Мембрана разряжается, а энергия электрохимического потенциала переходит в энергию макроэргических связей АТФ. В условиях организма в макроэргических связях АТФ аккумулируется около 60% энергии электрохимического потенциала, остальное ее количество рассеивается в виде тепла, за счет чего поддерживается температура тела.
Следует отметить, что протонный градиент на биомембранах может использоваться не только для синтеза АТФ, но и для других целей: для транспорта через мембраны нуклеозидди- и трифосфатов, для поддержания осмотического давления, для транспорта через мембраны веществ против градиента концентрации, для выработки тепла.
Таким образом, окислительное фосфорилирование – синтез АТФ из АДФ и неорганического фосфата за счет энергии электрохимического потенциала.
Для количественной оценки этого процесса введено понятие коэффициента фосфорилирования.
Коэффициент фосфорилирования – это отношение неорганического фосфата, потребляемого в процессе дыхания, к атому кислорода, т.е. Р/О. Это отношение равно 3 (если окисляемые субстраты переносят водороды на НАД) или 2 (если окисляемые субстраты переносят водороды на ФАД и далее по цепи ферментов), т.е. на каждый атом поглощенного кислорода в процессе дыхания образуется 3 или, соответственно, 2 АТФ.
Высокая эффективность реакций синтеза АТФ, сопряженных с переносом электронов по дыхательной цепи, может быть реализована только на специализированных мембранных структурах. В клетках человека и животных все основные процессы, связанные с окислительными превращениями пищевых веществ, в том числе и окислительное фосфорилирование, происходят в особых внутриклеточных органеллах, называемых митохондриями. В митохондриях клеток нашего организма вырабатывается более 90% всего количества энергии, необходимой для поддержания процессов жизнедеятельности.
Регуляция процесса окислительного фосфорилирования.
Регуляция окислительного фосфорилирования в клетке осуществляется несколькими механизмами.
1. В дышащих митохондриях скорость переноса электронов и скорость образования АТФ определяется в первую очередь относительными концентрациями АДФ и АТФ, а не концентрацией субстратов дыхания. В условиях избытка дыхательного субстрата максимальная скорость потребления кислорода достигается при высокой концентрации АДФ и фосфата и низкой концентрации АТФ. Если же концентрация АТФ велика, а концентрации АДФ и фосфата близки к нулю, то скорость дыхания митохондрий оказывается очень низкой, всего лишь 5-10% максимальной скорости. Это явление, т.е. изменение скорости дыхания с изменением концентрации АДФ, носит название дыхательного контроля или акцепторного контроля.
2. Концентрацией кислорода и количеством поступающих субстратов дыхания.
3. Ингибиторами дыхательной цепи и окислительного фосфорилирования. Ингибиторы можно разделить на 3 группы: ингибиторы собственно дыхательной цепи, ингибиторы окислительного фосфорилирования и разобщители окислительного фосфорилирования.
К ингибиторам дыхательной цепи относят барбитураты, антибиотики димеркапрол, антимицин А и др., классические яды – Н2S, СО, цианид. Они вызывают ингибирование ферментов дыхательной цепи.
Атрактилозид ингибирует окислительное фосфорилирование, блокируя транспорт АДФ в митохондрии и выход АТФ из митохондрий.
Разобщители нарушают систему сопряжения процессов окисления в дыхательной цепи и фосфорилирования. К ним относят протонные ионофоры – молекулы, переносящие протоны через мембрану, что приводит к выравниванию градиента рН и мембранного потенциала. Первым среди протонных ионофоров был найден 2,4-динитрофенол. Аналогичное действие оказывает ряд других соединений: динитрокрезол, антибиотик валиномицин. Таким образом, в присутствии протонных ионофоров энергия дыхания не превращается в химическую энергию , а рассеивается в виде тепла. Природными разобщителями окислительного фосфорилирования являются тироидные гормоны.
