
- •Введение в биоэнергетику Методическая разработка содержание
- •Введение
- •Термодинамика живых систем
- •Макроэргические соединения
- •Энергия и работа живых систем. Этапы преобразования энергии в живом организме
- •Основные этапы преобразования энергии в живом организме
- •Биологическое окисление и процессы энергетического сопряжения
- •Основные этапы биологического окисления.
- •Классификация процессов биологического окисления.
- •Характеристика ферментов дыхательной цепи митохондрий.
- •Механизм сопряжения дыхания и фосфорилирования. Теория окислительного фосфорилирования.
- •Биоэнергетика мышечной деятельности источники энергии при мышечной работе
- •Ресинтез атф в креатинфосфокиназнои реакции
- •Ресинтез атф в процессе гликолиза
- •Ресинтез атф в миокиназной реакции
- •Ресинтез атф в аэробном процессе
- •Литература
Характеристика ферментов дыхательной цепи митохондрий.
Первый тип переносчиков электронов и протонов (ферментов дегидрогеназ) в дыхательной цепи представлен никотинамидными коферментами - НАД (никотинамидадениндинуклеотид) и НАДФ (никотинамидадениндинуклеотидфосфат). Они состоят из: азотистых оснований – амида никотиновой кислоты (витамин В5) и аденина, двух углеводных компонентов – Д-рибозы, двух остатков фосфорной кислоты. НАДФ отличается от НАД наличием еще одной фосфатной группы у 2-го атома углерода аденилового нуклеотида.
Известно более 150 дегидрогеназ, коферментами которых являются НАД или НАДФ. Эти дегидрогеназы называются пиридинзависимыми, поскольку содержат никотинамид – производное пиридина. НАД и НАДФ обнаруживаются во всех типах клеток, причем НАД содержится в значительно больших количествах по сравнению с НАДФ. Дегидрогеназы, связанные с НАД, принимают участие, главным образом, в процессе дыхания (т.е. в переносе протонов и электронов от субстратов к кислороду), тогда как дегидрогеназы, связанные с НАДФ, участвуют преимущественно в переносе протонов и электронов от субстратов к восстановительным реакциям биосинтеза.
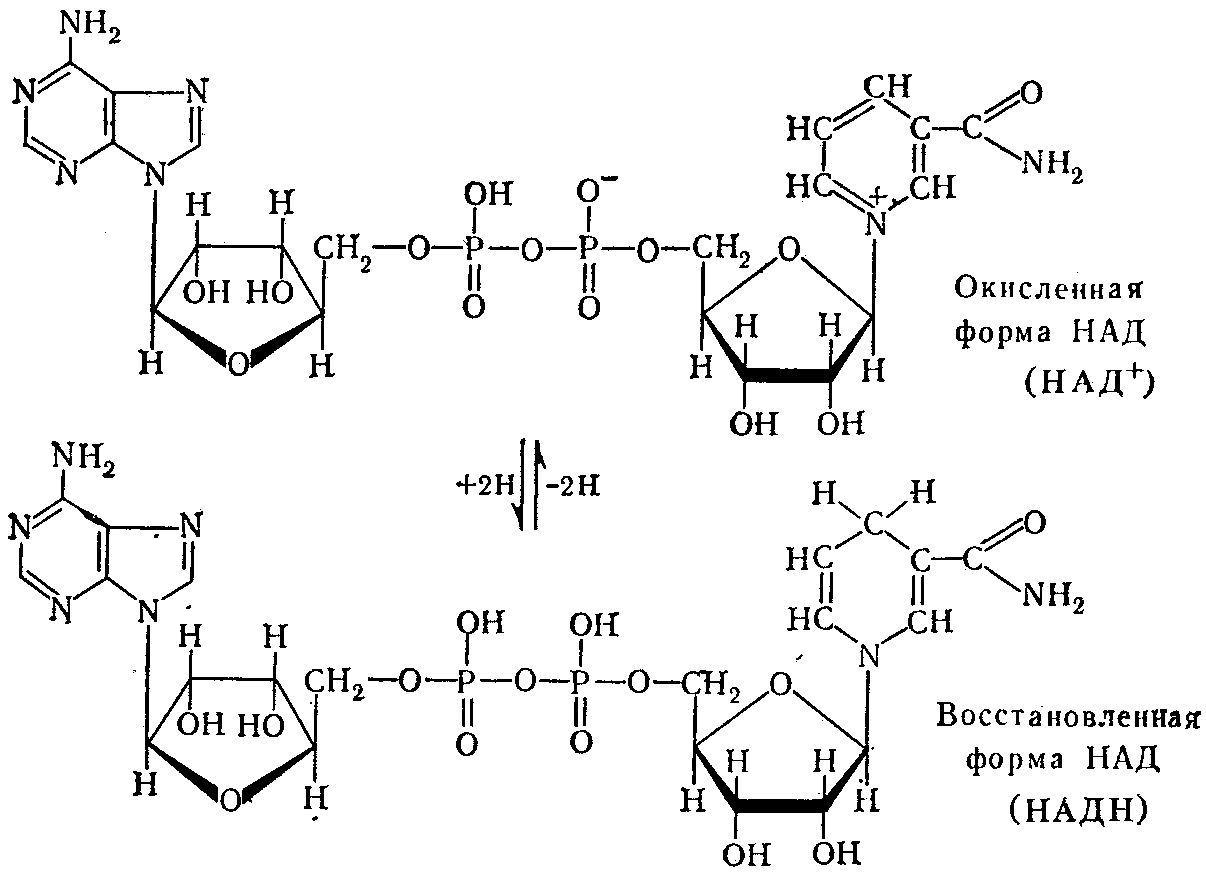
Механизм действия НАД и НАДФ. Коферменты НАД и НАДФ работают в клетке только вместе с белковой частью, образуя сложные ферменты дегидрогеназы. Специфичность связывания коферментов НАД и НАДФ с ферментами-белками зависит от адениннуклеотидной части их молекул, в то время как никотинамидная часть этих молекул осуществляет перенос электронов и протонов от окисляемого субстрата. Пиридиновое кольцо никотинамида имеет положительный заряд у четвертичного атома азота (поэтому окисленную форму НАД записывают в виде НАД+). Это вызывает смещение электронной плотности в пиридиновом кольце и появление положительного заряда у атома углерода в параположении. К нему присоединяется гидрид-ион (Н-), образующийся при неравномерном распределении электронов между атомами водорода: 2Н = Н- + Н+. Другой атом водорода, потерявший электрон (Н+), освобождается в окружающую среду, подкисляя ее. В результате образуется восстановленная форма НАД, записываемая в виде НАД.2Н или НАД.Н+Н+.
Дегидрогеназные реакции с участием в качестве коферментов НАД и НАДФ имеют ряд характерных особенностей, которые обусловливают их ключевую роль в процессах биологического окисления. Первая особенность дегидрогеназных реакций - их легкая обратимость при небольших изменениях свободной энергии, что позволяет коферментам участвовать как в окислении субстрата, так и в восстановлении продуктов реакции (в зависимости от потребностей клетки). Вторая особенность заключается в способности этих коферментов (как в окисленной, так и в восстановленной форме) легко отделяться от белка-носителя, их высокой подвижности, что облегчает обмен атомами водорода и электронами между различными дегидрогеназными системами, расположенными в разных частях клетки. Коферменты НАД и НАДФ способны акцептировать водород от большого числа субстратов, окислительно-восстановительный потенциал которых ниже -0,3 В. К числу таких субстратов относятся продукты расщепления углеводов, жиров и различных аминокислот.
В дыхательной цепи ферментов пиридинзависимые дегидрогеназы передают атомарные водороды другим переносчикам - флавиновым ферментам.
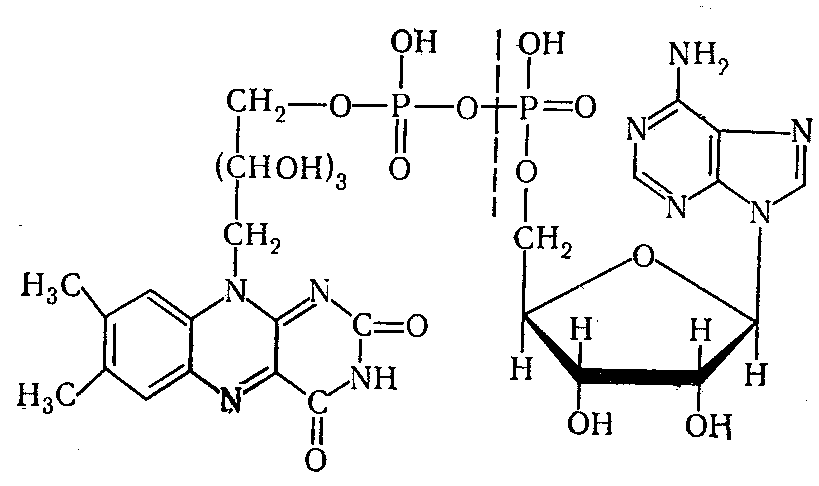
Флавиновые ферменты – это сложные ферменты, небелковая часть которых представлена простетическими группами ФМН (флавинаденинмононуклеотид) или ФАД (флавинадениндинуклеотид).
ФМН состоит из изоаллоксазинового кольца, спирта рибитола (вместе они образуют витамин В2 – рибофлавин) и фосфорной кислоты, ФАД содержит дополнительно адениловый нуклеотид. Молекулярная структура ФАД имеет вид:
В отличие от никотинамидных коферментов ФМН и ФАД прочно (ковалентно) связываются с соответствующими дегидрогеназными белками и не отщепляются ни на одной из стадий каталитического процесса. Реакции, катализируемые флавинзависимыми дегидрогеназами, трудно обратимы, и, следовательно, флавиновые коферменты не могут служить источником водородных атомов в процессах восстановительного биосинтеза, подобно никотинамидным коферментам.
Механизм действия ФМН и ФАД. Активной частью молекулы ФАД или ФМН служит изоаллоксазиновое кольцо рибофлавина. Два атома водорода (два протона и два электрона) присоединяются к первому и десятому атомам азота за счет внутримолекулярной перегруппировки двойных связей в кольце. Реакция восстановления ФМН имеет вид:
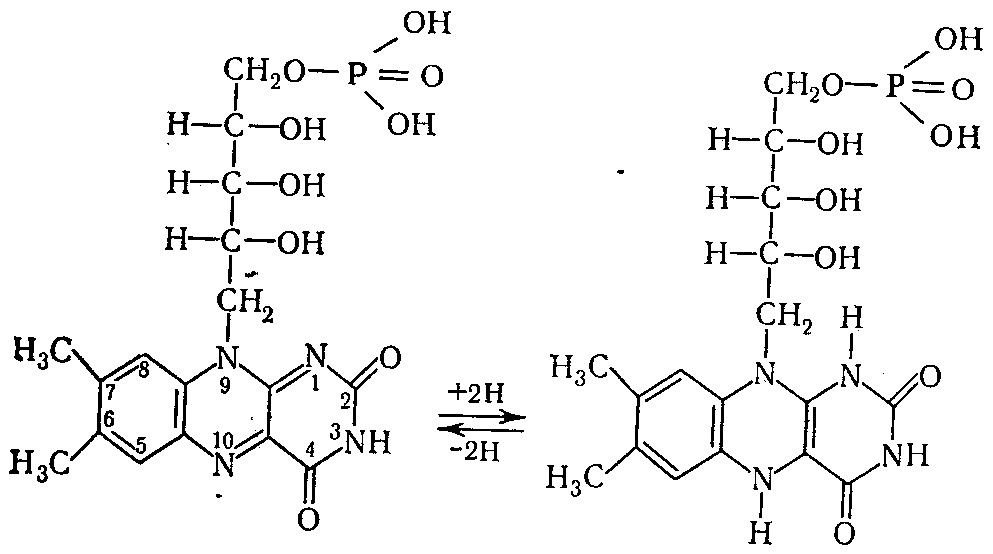
Окисленная форма ФМН Восстановленная форма ФМН.2Н
В соответствии с более положительными величинами окислительно-восстановительных потенциалов, чем у никотинамидных коферментов (около - 0,1 В), флавопротеиды могут акцептировать водород от НАД.2Н:
НАД.2Н + ФМН = НАД+ + ФМН.2Н.
Именно этот процесс протекает в дыхательной цепи ферментов на внутренней мембране митохондрий.
В некоторых случаях, например при окислении янтарной кислоты, α-глицерофосфата и КоА-производных жирных кислот, флавинзависимые ферменты могут играть роль первичных дегидрогеназ и непосредственно принимать электроны и протоны от окисляемых субстратов без участия НАД и связанных с ним дегидрогеназ.
В клетках также имеются аэробные флавиновые ферменты, осуществляющие перенос атомов водорода от субстрата к кислороду с образованием Н2О2.
Третий тип переносчиков электронов в дыхательной цепи представлен бензохиноновым соединением, носящим название кофермента Q или убихинон. Производное бензохинона имеет длинную изопреноидную цепь (для микроорганизмов n=6, для эукариот – 9). Убихинон свободно перемещается в липидной части внутренней мембраны митохондрий, и его быстрой диффузии способствует длинный неполярный хвост.
Механизм действия КоQ. При восстановлении убихинон, подобно флавиновым коферментам, присоединяет электроны и протоны. Он способен к одно- и двухэлектронному переносу, превращаясь в первом случае в полухинон КоQ.Н (семихинон), во втором в гидрохинон КоQ.2Н.
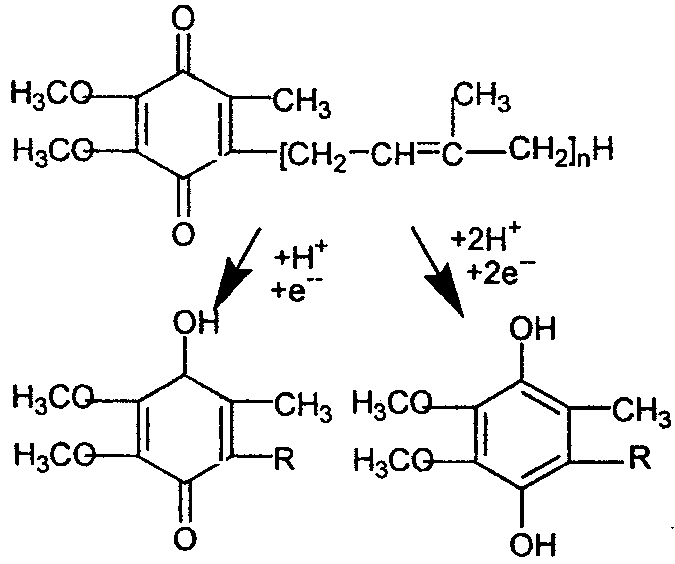
Полухинон (КоQ.Н) Гидрохинон (КоQ.2Н)
Кофермент Q имеет величину окислительно-восстановительного потенциала более положительную, чем у флавопротеидов (+0,02 В). В дыхательной цепи ферментов убихинон способен принимать водород от различных флавопротеидов:
ФМН.2Н + КоQ = ФМН + КоQ.2Н.
Система КоQ представляет собой узловой пункт, куда стекается водород, поступающий в дыхательную цепь от самых различных субстратов. Поэтому КоQ в дыхательной цепи представлен в более высоких концентрациях, чем большинство других переносчиков электронов. Хорошая растворимость в липидной фазе мембранных образований и относительно небольшой молекулярный вес придают коферменту свойство подвижного переносчика, взаимодействующего с фиксированными электронпереносящими белками.
Четвертый тип переносчиков электронов в дыхательной цепи от КоО. на кислород представлен группой различных гемосодержащих белков (гемопротеидов), называемых цитохромами. Отличаясь друг от друга структурой белкового компонента, все они имеют простетическую геминовую группу, близкую по своему строению к гему гемоглобина. В центре порфиринового кольца каждого тема находится ион железа. Группы цитохромов а, b и с отличается между собой сторением апофермента, строением простетической группы, характером связи между простетической группой и апоферментом.
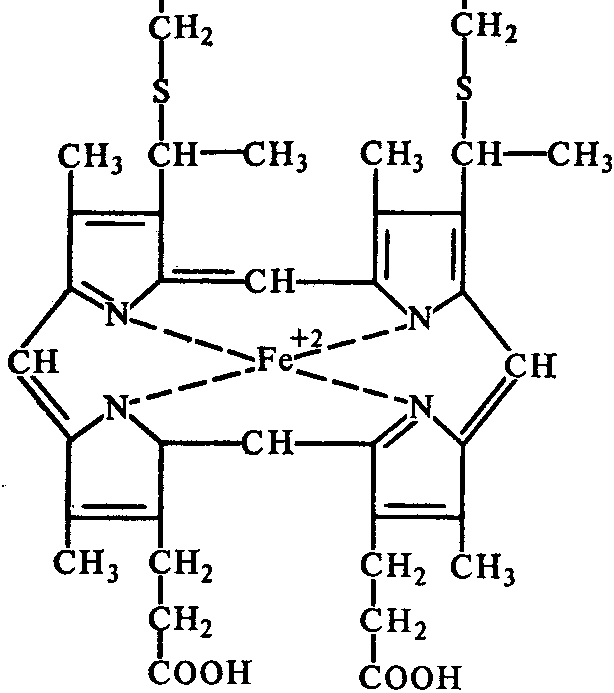
Простетическая группа цитохрома с
Механизм действия цитохромов. В отличие от флавопротеидов, которые функционируют одновременно, перенося водород от различных субстратов на общий акцептор КоQ, цитохромы действуют последовательно, перенося электроны от КоQ на конечный акцептор - кислород. На участке дыхательной цепи между НАД и КоQ осуществляется двухэлектронный перенос, тогда как цитохромы, действующие на участке между КоQ и кислородом, переносят лишь по одному электрону. При этом происходит обратимое окисление-восстановление атома железа простетической группы, переходящего из Fе2+ в Fе3+. Следовательно, на данном участке дыхательной цепи должны действовать две молекулы цитохромов.
В соответствии с величиной окислительно-восстановительного потенциала у разных цитохромов они располагаются в определенной последовательности в дыхательной цепи между КоQ и кислородом:
цит. b > цит. с1 > цит. с > цит. а > цит. а3 > О2
+ 0,03 В +0,22В +0,24 В +0,25 В +0,39 В +0,82 В
В этой же последовательности происходит перенос электронов.
Переносчиком электронов во всех цитохромах (а, b, с) является железо, однако оно не способно отдавать электроны кислороду. Такой способностью обладает медь, которая принимает электроны от Fe в цитохроме а3 (цитохромоксидазный комплекс). Поэтому завершающей является реакция, катализируемая ферментом-цитохромоксидазой - сложным гемопротеидом, состоящим из 7 полипептидных цепей, двух различных гемов, которые обозначаются как цитохромы а и а3, и двух атомов меди, принимающих участие в транспорте электронов: Сu2+ + е = Сu+.
Первый из цитохромов на этом участке - цитохром а - реагирует с цитохромом с, принимает электроны и переносит их на цитохром а3, содержащий ионы меди, который способен прямо взаимодействовать с кислородом как конечным акцептором электронов.
«Активный» кислород присоединяет два протона из окружающей среды, образуя воду. В этой реакции кислород, как наиболее сильный окислитель, акцептируя электроны, создает основную движущую силу для переноса электронов вдоль дыхательной цепи. Кислород обеспечивает отток электронов из дыхательной цепи, в результате чего все выше расположенные переносчики поддерживаются в окисленном состоянии и оказываются способными принимать водород и электроны, поставляемые от окисляемых субстратов.
На различных участках дыхательной цепи наряду с названными основными переносчиками (флавопротеидами, КоQ и цитохромами) в транспорте электронов принимают участие белки, содержащие негеминовое железо, в молекуле которых железо связывается с белком-носителем через атом серы.
Обычно реакции окисления, связанные с отщеплением водорода от молекул органических субстратов при участии НАД или ФАД зависимых дегидрогеназ, обозначают как первичное окисление, а последовательность окислительно-восстановительных реакций в дыхательной цепи - как терминальное окисление.
