
- •Глава 9 Блохин а.В.
- •Глава 9 Растворимость твердых веществ в жидкостях. Коллигативные свойства растворов.
- •9.1. Растворимость твердых веществ в жидкостях.
- •Коллигативные свойства растворов
- •9.2. Понижение температуры замерзания растворов. Криоскопия.
- •9.3. Повышение температуры кипения растворов нелетучих веществ. Эбулиоскопия.
- •9.4. Термодинамика осмотического давления.
- •9.5. Коллигативные свойства разбавленных растворов.
- •9.6. Методы определения активностей в бинарных растворах.
9.5. Коллигативные свойства разбавленных растворов.
Зависимость коллигативных свойств разбавленных растворов от концентрации выражается простыми линейными уравнениями. Остановимся на каждом из них подробнее.
1. Понижение давления пара растворителя над раствором. Закон Рауля, которому подчиняется растворитель в разбавленных растворах, можно представить в следующем виде:
![]() ,
,
![]() ,
,
![]() , (9.55)
, (9.55)
где постоянная KV определяется только свойствами растворителя и температуры.
2. Понижение температуры замерзания раствора. Для разбавленных растворов
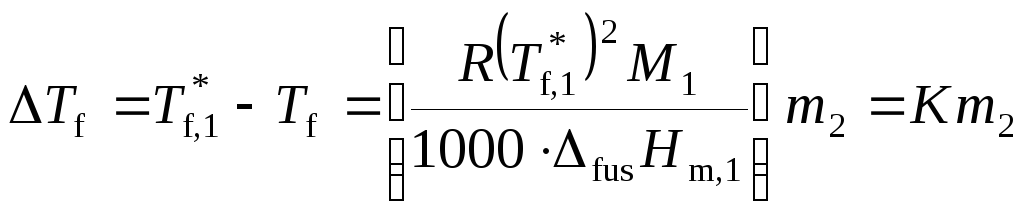 ,
,
где криоскопическая постоянная К определяется только свойствами растворителя.
3. Повышение температуры кипения раствора нелетучего вещества. Для разбавленных растворов
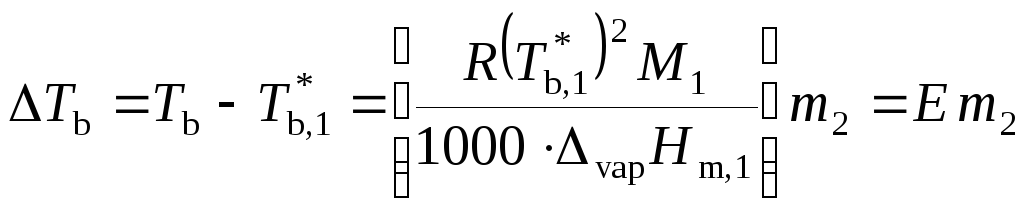 ,
,
где эбулиоскопическая постоянная Е определяется только свойствами растворителя.
4. Осмотическое давление раствора. Для разбавленных растворов можно принять, что объем раствора равен объему растворителя, тогда
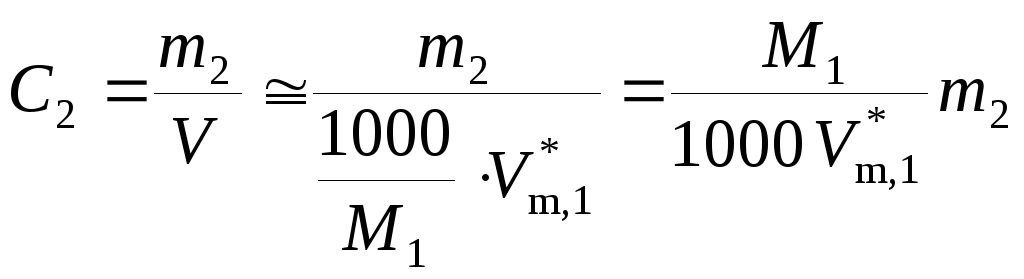 ,
,
где
![]() – молярный объем растворителя.
– молярный объем растворителя.
Следовательно, уравнение Вант-Гоффа для осмотического давления разбавленных растворов можно записать следующим образом:
 , (9.56)
, (9.56)
где постоянная Kосм определяется только свойствами растворителя и температуры.
Итак, рассмотренные свойства (понижение давления пара растворителя, понижение температуры замерзания, повышение температуры кипения раствора нелечучих веществ и осмотическое давление) целиком определяются для разбавленных растворов свойствами растворителя и температуры и линейно зависят только от количества молей растворенного вещества, но не от его природы. Именно такие свойства, линейно зависящие от моляльности, и называются коллигативными.
Следует отметить, что если растворенное вещество диссоциирует (растворы электролитов) или ассоциирует (водные растворы органических кислот) в растворе, то в вышеприведенные формулы вводится изотонический коэффициент:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
9.6. Методы определения активностей в бинарных растворах.
В бинарных растворах активность растворителя можно определить следующими, обоснованными в п. 8.10 и 9.2 – 9.4, основными методами:
1. по измерению давления пара растворителя над раствором:
![]() ;
;
2. по измерению температуры замерзания раствора:
![]() ;
;
3. по измерению температуры кипения раствора:
![]() ;
;
4. по измерению осмотического давления раствора:
![]() ;
;
Наиболее чувствительным из представленных методов является способ определения активности растворителя по осмотическому давлению. Так, например, коллигативные свойства разбавленного бинарного водного раствора с моляльностью m2 = 0,001 моль∙кг–1 равны:
![]() (при 20 °С),
(при 20 °С),
![]() ;
;
![]() ;
;
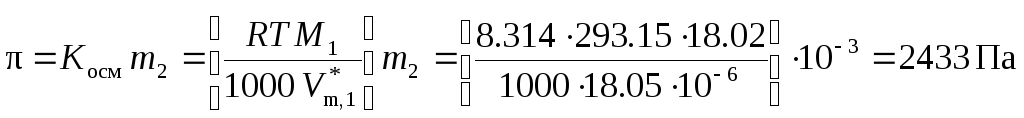 .
.
Активность растворенного вещества в бинарном растворе можно найти следующими методами:
