
- •Глава 9 Блохин а.В.
- •Глава 9 Растворимость твердых веществ в жидкостях. Коллигативные свойства растворов.
- •9.1. Растворимость твердых веществ в жидкостях.
- •Коллигативные свойства растворов
- •9.2. Понижение температуры замерзания растворов. Криоскопия.
- •9.3. Повышение температуры кипения растворов нелетучих веществ. Эбулиоскопия.
- •9.4. Термодинамика осмотического давления.
- •9.5. Коллигативные свойства разбавленных растворов.
- •9.6. Методы определения активностей в бинарных растворах.
9.3. Повышение температуры кипения растворов нелетучих веществ. Эбулиоскопия.
Раствор, как и любая жидкость, кипит, когда давление насыщенного пара становится равным внешнему давлению. Поскольку растворенное вещество нелетуче, пар над раствором содержит только растворитель. Давление насыщенного пара растворителя над раствором всегда меньше давления насыщенного пара над чистым растворителем при той же температуре, поэтому раствор кипит при более высокой температуре по сравнению с чистым растворителем.
В случае идеальных и предельно разбавленных растворов для растворителя выполняется закон Рауля, поэтому в точке кипения раствора
![]() , (9.29)
, (9.29)
где Pвн – внешнее давление. Проведем логарифмирование (9.29) и затем дифференцирование полученного выражения по температуре:
![]() ,
,
![]() .
.
Поскольку внешнее давление не зависит от температуры, то
![]() ,
,
![]() . (9.30)
. (9.30)
По уравнению Клапейрона – Клаузиуса
![]() , (9.31)
, (9.31)
тогда
![]() . (9.32)
. (9.32)
Разделим переменные и проинтегрируем выражение (9.32) при условии, что энтальпия испарения не зависит от температуры:
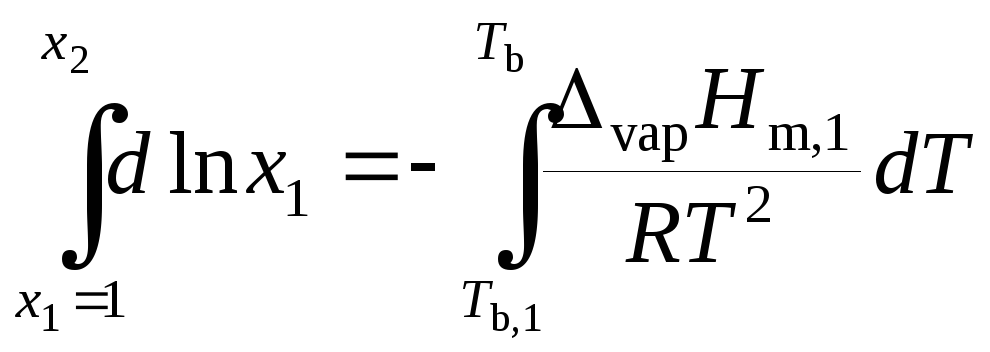 ,
,
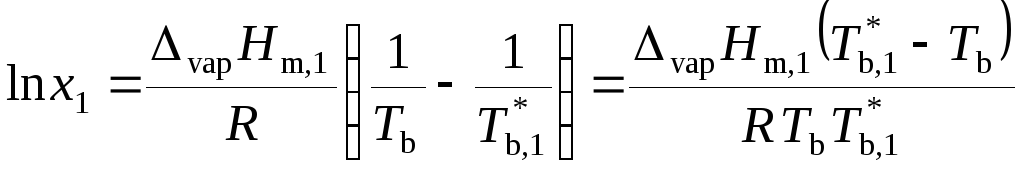 , (9.33)
, (9.33)
![]() , (9.34)
, (9.34)
где
![]() и Tb
– температуры кипения чистого растворителя
и раствора;
и Tb
– температуры кипения чистого растворителя
и раствора;
![]() – повышение температуры кипения
раствора.
– повышение температуры кипения
раствора.
Для разбавленных растворов можно принять (см. п. 9.2), что
![]() ,
,
![]() ,
,
![]() ,
,
тогда
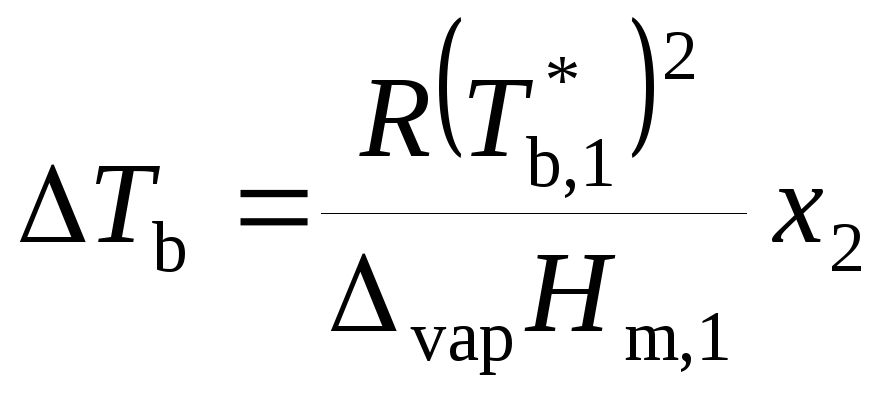 , (9.35)
, (9.35)
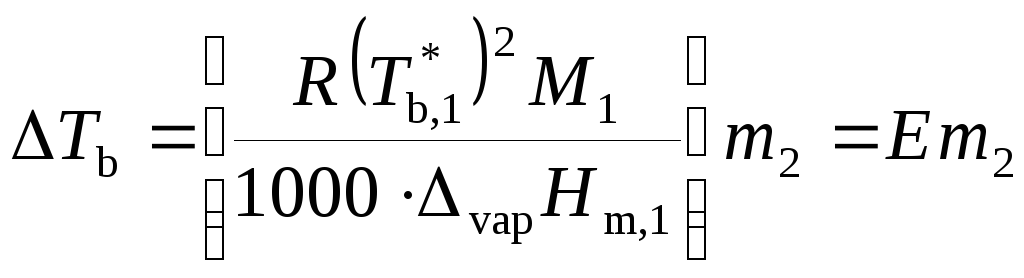 , (9.36)
, (9.36)
где
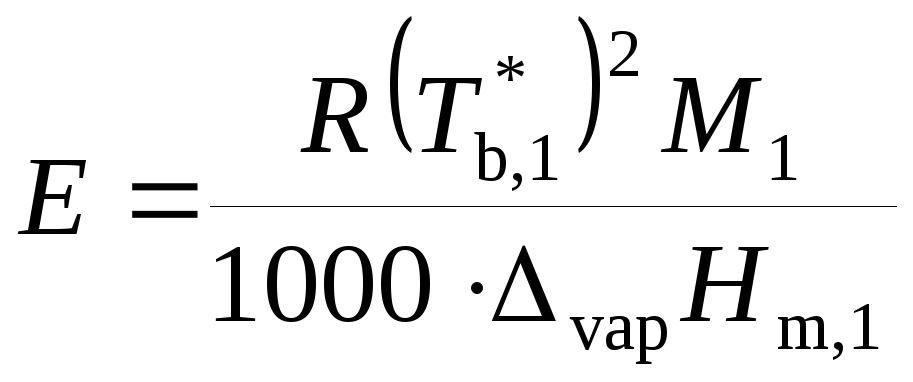 .
.
Величину Е называют эбулиоскопической постоянной растворителя или моляльным повышением температуры кипения раствора (если m2 = 1, то ΔTb = E). Значение Е определяется только свойствами растворителя.
Метод определения молярной массы растворенного вещества, основанный на явлении повышения температуры кипения раствора по сравнению с чистым растворителем, называется эбулиоскопическим или просто эбулиоскопией. Формула для расчета молярной массы аналогична выражению (9.23):
![]() . (9.37)
. (9.37)
Результаты эбулиоскопических определений, как правило, менее точны по сравнению с криоскопическими измерениями, поскольку эбулиоскопические постоянные меньше криоскопических (например, для воды они равны 0.52 и 1.86 соответственно).
Для растворов электролитов по повышению температуры кипения раствора можно определить изотонический коэффициент и далее оценить степень диссоциации, поскольку
![]() ,
,
![]() . (9.38)
. (9.38)
Для реальных растворов уравнения (9.32) и (9.33), справедливые для предельно разбавленных и идеальных растворов, принимают вид:
![]() , (9.39)
, (9.39)
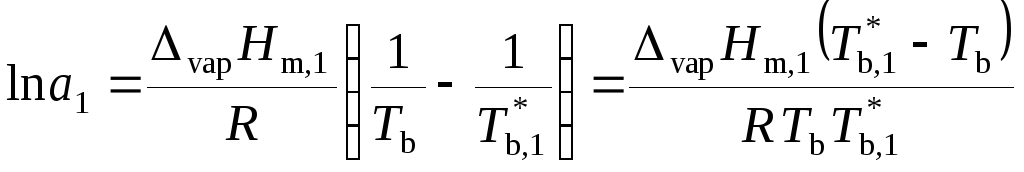 , (9.40)
, (9.40)
![]() . (9.41)
. (9.41)
Уравнение (9.41) позволяет рассчитать активность растворителя на основе опытной величины повышения температуры кипения раствора.
Уменьшение давления насыщенного пара растворителя над раствором обусловлено уменьшением химического потенциала растворителя в присутствии растворенного вещества. На рис. 9.1 представлена температурная зависимость давления насыщенного пара над чистым твердым и жидким растворителем (кривые DO и ОА) и его парциального давления пара над растворами разных составов (кривые ОВ и ОС). Точки А, B и С являются нормальными точками кипения чистого растворителя и растворов, а соответствующие им температуры – нормальными температурами кипения. Из рис. 9.1 видно, что температуры кипения растворов Tb и Tb выше температуры кипения чистого растворителя Tb.
Точка О соответствует равновесию между кристаллической и жидкой фазами чистого растворителя (фактически это температура замерзания чистого растворителя). Температурная зависимость давления пара над чистым переохладенным жидким растворителем представлена кривой АО, а над переохлажденными растворами – кривыми BO и CO.
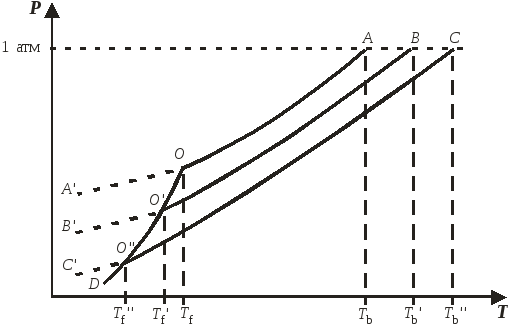
Рис. 9.1. Зависимости давления насыщенного пара растворителя над чистым веществом и растворами от температуры.
Кристаллы растворителя будут находиться в равновесии с раствором тогда, когда давления пара растворителя над твердой и жидкой фазами будут равны. Это условие выполняется в точках O и O – точках пересечения кривой DО и кривых ВВ и CC. Температуры Tf и Tf, соответствующие эти точкам, являются температурами замерзания растворов и, как видно из рис. 9.1, они меньше температуры замерзания Tf для чистого растворителя.
