
- •Глава 9 Блохин а.В.
- •Глава 9 Растворимость твердых веществ в жидкостях. Коллигативные свойства растворов.
- •9.1. Растворимость твердых веществ в жидкостях.
- •Коллигативные свойства растворов
- •9.2. Понижение температуры замерзания растворов. Криоскопия.
- •9.3. Повышение температуры кипения растворов нелетучих веществ. Эбулиоскопия.
- •9.4. Термодинамика осмотического давления.
- •9.5. Коллигативные свойства разбавленных растворов.
- •9.6. Методы определения активностей в бинарных растворах.
9.4. Термодинамика осмотического давления.
Если растворитель и раствор разделены полупроницаемой (т. е. проницаемой только для молекул растворителя) мембраной, то в силу различия химических потенциалов растворителя в растворе и чистого растворителя
![]() (р–р)
<
(р–р)
<
![]() (ж)
(ж)
через мембрану будет наблюдаться массоперенос (диффузия) растворителя в раствор. Например, если трубку, заполненную раствором сахара, отделить от воды полупроницаемой мембраной (которая пропускает только молекулы воды, но не сахара), то начнется диффузия молекул воды в раствор и уровень жидкости в трубке станет подниматься. Это поднятие уровня жидкости приведет к увеличению давления в нижней части раствора и, следовательно, увеличению химического потенциала растворителя. При некоторой высоте столба раствора в трубке химические потенциалы чистой воды и воды в нижней части раствора станут равны, скорости диффузии воды из наружного сосуда во внутренний и обратно сравняются и подъём жидкости в трубке прекратится (система придёт в равновесие).
Явление самопроизвольного перехода растворителя в раствор, отделенный от него полупроницаемой мембраной, называется осмосом. Сила, действующая на единицу площади мембраны и заставляющая переходить растворитель в раствор, называется осмотическим давлением и обозначается π. Другими словами, осмотическое давление – это давление, которое нужно приложить в процессе осмоса к раствору, чтобы привести его уровень к уровню чистого растворителя.
Количественная зависимость для осмотического давления разбавленных растворов впервые была предложена Вант-Гоффом (1885):
![]() или
или
![]() , (9.42)
, (9.42)
где С2 – молярная концентрация растворенного вещества (моль∙м–3); n2 – химическое количество (моль) растворенного вещества; V – объем раствора (м3). Осмотическое давление в разбавленных растворах численно равно тому давлению, которое производило бы то же число молекул растворенного вещества, если бы оно в виде идеального газа занимало при данной температуре объем, равный объему раствора. (Кстати, первая Нобелевская премия по химии в 1901 году была присуждена именно Якобу Хенрику Вант-Гоффу за открытие законов химической динамики и осмотического давления в растворах).
Следует отметить, что аналогия между уравнением Вант-Гоффа и уравнением состояния идеального газа случайна и не имеет существенного значения. Осмотическое давление является тем добавочным давлением, которое увеличивает химический потенциал растворителя в растворе и этим компенсирует уменьшение химического потенциала растворителя, вызванное растворением второго компонента. Такая компенсация создает возможность равновесия раствора с чистым растворителем в особых условиях наличия полупроницаемой перегородки. Без этой перегородки осмотическое давление отсутствует.
Итак, по условию равновесия при постоянной температуре в рассматриваемой системе
![]() и
и
![]() ,
,
где
![]() – химический потенциал чистого
растворителя при данной температуре и
внешнем давлении Рвн;
– химический потенциал чистого
растворителя при данной температуре и
внешнем давлении Рвн;
![]() – химический потенциал растворителя
в растворе, зависящий от состава раствора
(х1)
и давления Р2 ,
равного
сумме внешнего и осмотического давлений:
– химический потенциал растворителя
в растворе, зависящий от состава раствора
(х1)
и давления Р2 ,
равного
сумме внешнего и осмотического давлений:
![]() .
.
Найдем зависимость осмотического давления от состава раствора (x1) при постоянном внешнем давлении (Рвн = const) и заданной температуре (T = const). При указанных условиях химический потенциал чистого растворителя остается постоянным, следовательно
![]()
или просто
![]() .
.
Химический потенциал растворителя в растворе зависит от x1 и давления Р2, поэтому
![]() . (9.43)
. (9.43)
Определим, чему равны частные производные в (9.43). Поскольку
![]() и
и
![]() ,
,
то
![]() . (9.44)
. (9.44)
Далее, поскольку в реальном жидком растворе
![]() ,
,
то
![]() . (9.45)
. (9.45)
При подстановке полученных выражений (9.44) и (9.45) в уравнение (9.43) получаем:
![]() ,
,
![]() . (9.46)
. (9.46)
При интегрировании выражения (9.46) от P2 = Pвн и a1 = 1 (x1 = 1) до P2 = (Pвн + π) и a1 в предположении, что парциальный молярный объем растворителя остается постоянным, получаем:
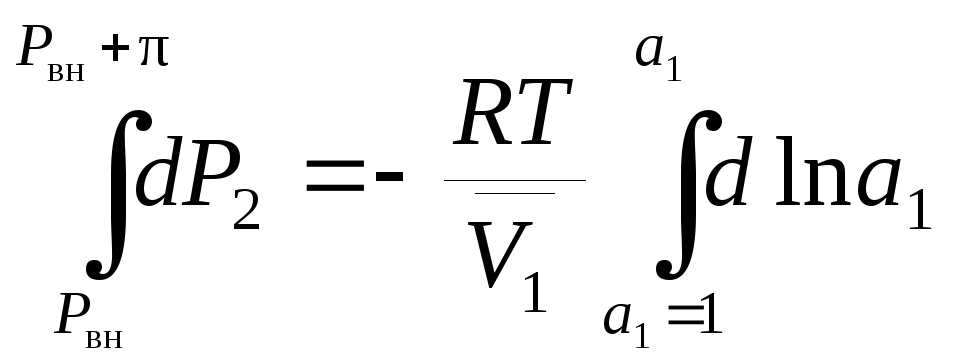 ,
,
![]() . (9.47)
. (9.47)
Поскольку для реальных растворов
![]() ,
,
то уравнение осмотического давления принимает вид
![]() . (9.48)
. (9.48)
В случае идеальных и предельно разбавленных растворов для растворителя выполняется закон Рауля
![]() ,
,
поэтому
![]() . (9.49)
. (9.49)
Значит, осмотические давления реального (πреал) и идеального (πид) растворов с одной и той же концентрацией растворенного вещества не равны между собой. Указанное различие характеризуется осмотическим коэффициентом, равным
![]() . (9.50)
. (9.50)
Найдем связь между коэффициентом активности растворителя и осмотическим коэффициентом раствора:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() . (9.51)
. (9.51)
Для разбавленных бинарных растворов, в которых растворитель подчиняется закону Рауля, справедливо, что
![]() ,
,
и поэтому уравнение (9.48) принимает вид
![]() . (9.52)
. (9.52)
С
учетом того, что для разбавленных
растворов ![]() и
и
![]() ,
,
и объем раствора приближенно равен объему растворителя
![]() ,
,
уравнение (9.52) преобразуется в уравнение Вант-Гоффа:
![]() . (9.53)
. (9.53)
Отметим, что осмотическое давление 1 молярного раствора равно примерно 25 атм. Осмотические эффекты чрезвычайно важны в биологических системах, поскольку большинство биологических мембран – стенки кишечника, стенки клеток – полупроницаемы. Слишком большой градиент концентрации приводит к разрыву или высушиванию клетки. Очень эффективным осмотическим устройством является человеческая почка. В почке кровь и моча движутся навстречу друг другу с противоположных сторон ряда полупроницаемых мембран, которые позволяют ненужным ионам и низкомолекулярным продуктам обмена веществ перейти из крови в мочу, а другим, нужным ионам (например, Na+ и Cl–) перейти обратно из мочи в кровь.
Измерение осмотического давления растворов полимеров очень удобно для измерения их средней молярной массы, поскольку из уравнения Вант-Гоффа следует, что
![]() , (9.54)
, (9.54)
где g2 – навеска полимера, V – объем растворителя.
Растворы с одинаковыми значениями осмотического давления называются изотоническими.
