
- •Часть I. Электрохимия
- •Литература
- •1. Теоретическая часть
- •Работа № 3 потенциометрический метод определения активности ионов в растворе
- •1. Теоретическая часть
- •Если обозначить стандартный потенциал хлорсеребряного электрода, окончательно выражение для потенциала хлорсеребряного электрода принимает вид:
- •Потенциалом стеклянного электрода называется сумма всех трех скачков потенциала:
- •Окислительно-восстановительных электродов
- •1. Теоретическая часть
- •Поскольку потенциал хингидронного электрода (см. Ранее) определяется уравнением Нернста:
- •Отсюда следует, что для определения стандартного потенциала хингидронного электрода необходимо измерить значение эдс гальванического элемента при рН равном нулю:
- •Буферная система: о.1 н раствор лимонной кислоты (с6н8о7) и 0.2 н раствор Nа2нро4
Работа № 3 потенциометрический метод определения активности ионов в растворе
Потенциометрическим
называется метод, основанный на измерении
ЭДС гальванических элементов. В данном
случае
элементов, составленных из измерительного
электрода, потенциал которого зависит
от активности (![]() )
определяемого иона, и электрода сравнения,
потенциал которого является точно
известной и постоянной величиной. В
качестве измерительных могут применяться
практически любые электроды, потенциал
которых зависит от измеряемой величины.
Электродами сравнения чаще всего служат
трехфазные электроды второго рода −
хлорсеребряный или каломелевый.
)
определяемого иона, и электрода сравнения,
потенциал которого является точно
известной и постоянной величиной. В
качестве измерительных могут применяться
практически любые электроды, потенциал
которых зависит от измеряемой величины.
Электродами сравнения чаще всего служат
трехфазные электроды второго рода −
хлорсеребряный или каломелевый.
1. Теоретическая часть
1.1. Электроды первого рода. Электродами первого рода называются такие электроды, потенциал которых зависит от активности либо катионов, либо анионов. Они бывают двухфазными и трехфазными (газовые электроды). Двухфазные электроды первого рода, состоящие из металла, погруженного в раствор его соли, уже были рассмотрены ранее (см. серебряный, цинковый, медный электроды). Их потенциалы зависят от активности катиона металла в растворе:
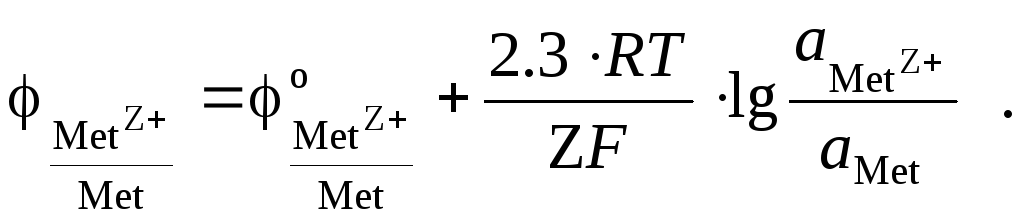
Примером двухфазного электрода первого рода, потенциал которого зависит от активности аниона, может служить селеновая пластинка, погруженная в раствор селеноводорода или его соли, например:
Se![]() ,
или Se
,
или Se![]() .
.
Электрохимической реакцией, протекающей на поверхности такой пластинки, является восстановление селена:
![]()
Чем
больше концентрация, или активность
анионов
![]() ,
тем дальше это равновесие смещается
влево, тем больше электронов попадает
в селеновую пластинку, тем отрицательнее
становится потенциал такого электрода:
,
тем дальше это равновесие смещается
влево, тем больше электронов попадает
в селеновую пластинку, тем отрицательнее
становится потенциал такого электрода:
![]()

К трехфазным электродам первого рода относятся газовые электроды: водородный, кислородный, хлорный и т.д. Все они устроены одинаково и различаются лишь природой электрохимической реакции, протекающей на поверхности раздела между металлом и раствором. Так, водородный электрод представляет собой платиновую пластинку, покрытую мелкораздробленной платиной, находящуюся в контакте как с газообразным водородом, так и с водным раствором, содержащим ионы водорода. Его схема может быть представлена как:
PtH2H+ .
На поверхности раздела раствор платина устанавливаются равновесия адсорбции водорода
![]()
и окисления адсорбированного водорода до ионов водорода, переходящих в раствор
![]()
Суммарное равновесие электрохимической реакции, протекающей на поверхности платиновой пластинки может быть записано как
![]()
В соответствии с этой электродной реакцией, уравнение Нернста для водородного электрода принимает вид:
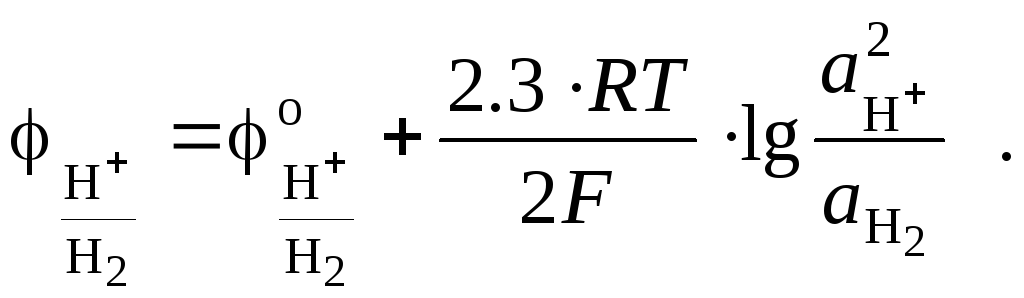
Если водород, пропускаемый через электрод, является химически чистым, его активность равна относительной фугитивности, а если давление достаточно мало и газ можно считать идеальным, то активность водорода равна его относительному давлению:
![]()
![]() ,
,
где
![]() 1.0133105
Па = 1 атм =
760 мм.рт.ст.
стандартное давление.
1.0133105
Па = 1 атм =
760 мм.рт.ст.
стандартное давление.
В
случае, когда водород через электрод
пропускают при стандартном давлении
(![]() ),
его активность равна единице. Значение
стандартного потенциала водородного
электрода при любых температурах
принимается равным нулю (
),
его активность равна единице. Значение
стандартного потенциала водородного
электрода при любых температурах
принимается равным нулю (![]() .000
В), и поэтому
.000
В), и поэтому
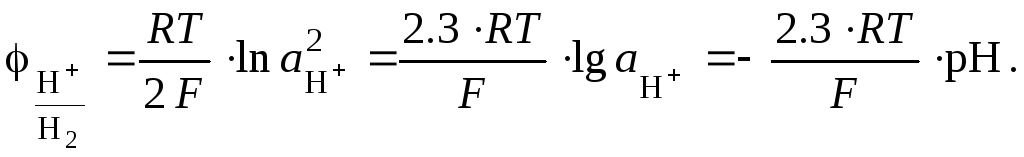
Следовательно, с увеличением рН среды потенциал водородного электрода становится все более отрицательным.
На кислородном электроде устанавливается суммарное равновесие
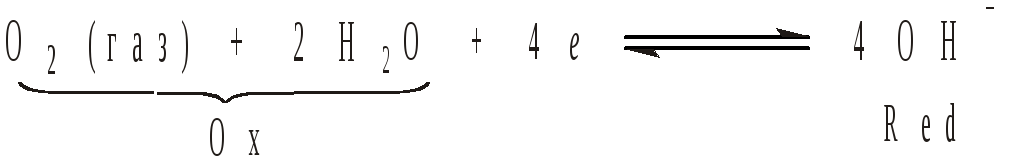
и поэтому потенциал такого электрода определяется соотношением
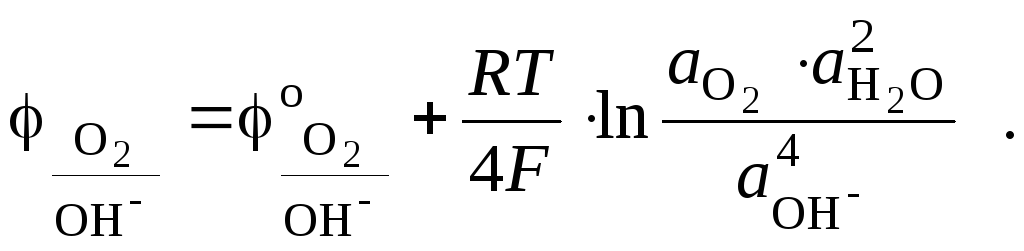
Если
давление кислорода равно атмосферному,
а раствор достаточно разбавлен, то
![]() ,
и в этом случае:
,
и в этом случае:
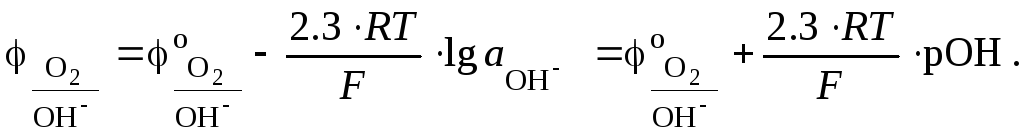
Поскольку
рОН =
lg
![]() =
14
рН, то окончательно:
=
14
рН, то окончательно:
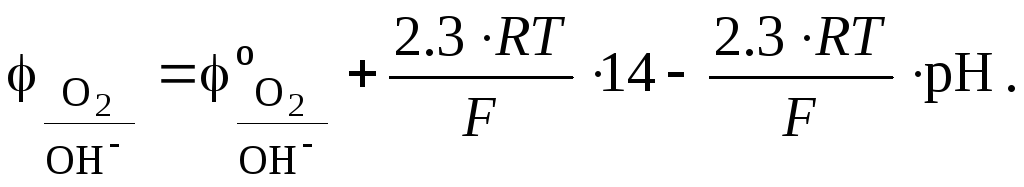
С ростом рН среды потенциал кислородного электрода также становится все более отрицательным.
1.2. Электроды второго рода. Электроды второго рода являются трехфазными и состоят из металлической пластинки, погруженной в насыщенный раствор труднорастворимой соли этого металла (ее обычно наносят на поверхность пластинки), и хорошо растворимой соли, содержащей одноименный анион. Типичным примером электрода второго рода является хлорсеребряный электрод, схема которого может быть записана как
AgAgClKCl .
На поверхности серебряной пластинки устанавливается электрохимическое равновесие восстановления катионов серебра, то есть электродная реакция, аналогичная протекающей на серебряном электроде первого рода:
![]()
поэтому потенциал хлорсеребряного электрода определяется тем же выражением, что и в случае серебряного электрода (см. стр. 26):
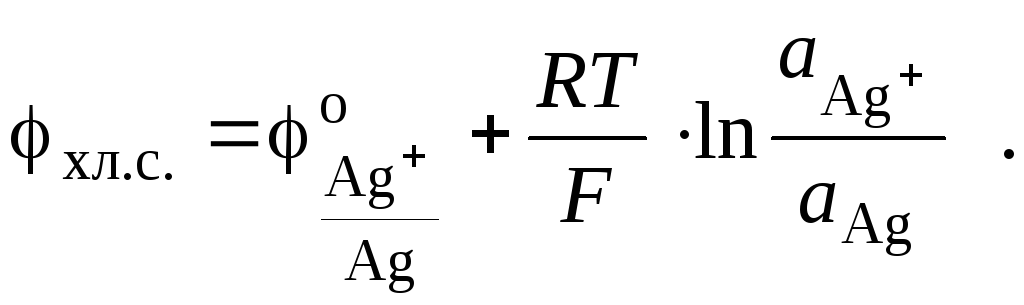
Поскольку
раствор AgCl
является насыщенным, активности катионов
серебра и анионов хлора связаны
соотношением, называемым произведением
растворимости:
![]() , откуда
, откуда
![]() .
Если подставить это выражение в уравнение
Нернста для хлорсеребряного электрода
и учесть, что активность химически
чистого серебра равна единице, можно
получить
.
Если подставить это выражение в уравнение
Нернста для хлорсеребряного электрода
и учесть, что активность химически
чистого серебра равна единице, можно
получить
![]()
