
Особенности окиси азота
Окись азота NO (мон(о)оксид азота, оксид азота II, нитрозил-радикал) еще один несолеобразующий оксид азота, образующийся в тропосфере в процессе денитрификации, а также при грозовых разрядах. В стратосфере NO образуется также в результате окисления закиси азота атомарным кислородом.
NO представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Оксид азота NO также обладает свойствами парникового газа, поскольку в спектре его поглощения присутствует линия с длиной волны 5,3 мкм.
Окись азота NO имеет плотность по отношению к воздуху 1,041 (Томсон), 1,094 (Дэви). При -11° и 104 атмосферах давления он сгущается в бесцветную жидкость с температурой абсолютного кипения -93°.
Структура молекулы NO приведена на рисунке 1.
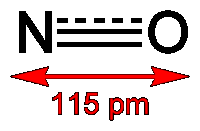
Рисунок 1. Структура молекулы NO
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Жидкий оксид азота(II) на 25 % состоит из молекул N2O2, а твердый оксид целиком состоит из них.
Оксид азота (II) — единственный из оксидов азота, который можно получить непосредственно путем химической реакции азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. При этом потребляется тепло.
N2 + O2 → 2NO — 180,9 кДж
В лабораторных условиях NO получается из высших степеней окисления азота. В качестве примера можно привести реакцию азотной кислоты с медью:
8HNO3 + 3Cu = 4H2O + 3Cu(NO3)2 + 2NO
Окись азота поглощается растворами многих кислот и солей, особенно растворами солей закиси железа, образуя весьма нестойкие соединения, выделяющие окись азота при нагревании или при пропускании струи водорода.
Окись азота, по наблюдениям Бертело разлагается лишь при нагревании выше 520° :
2NO = N 2 + O2
2NO = N 2 O + O,
Полное разложение наступает только при температуре плавления платины; при 520°, по Бертело, преобладает образование закиси азота.
При разложении 2NO = N 2 + O2 выделяется 43,4 кал., а потому некоторые тела горят в окиси азота более энергично, чем на воздухе.
Горение в NO отличается от горения в чистом кислороде тем, что гореть способны в окиси азота лишь вещества, температура горения которых достаточно высока для того, чтобы вызвать разложение NO.
Зажженный фосфор в NO продолжает гореть, а сера и уголь тухнут. Угль горит лишь, если его предварительно сильно накалить.
При понижении температуры NO может разлагаеться на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
При комнатной температуре и атмосферном давлении окисление NO кислородом воздуха происходит практически мгновенно:
2NO + O2 → 2NO2
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов. В них NO проявляет свойства восстановителя:
2NO + Cl2 → 2NOCl (нитрозилхлорид).
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
2SO2 + 2NO → 2SO3 + N2↑.
В воде NO мало растворим и с ней не реагирует.
NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное.
NO участвует в регуляции систем внутри- и межклеточной сигнализации. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение.
NO предотвращает агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в различных процессах в нервной, репродуктивной и иммунной системах.
NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как эссенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
Характерной особенностью NO является способность быстро (менее чем за 5 секунд) диффундировать через мембрану синтезировавшей его клетки в межклеточное пространство и легко (без участия рецепторов) проникать в клетки-мишени. Внутри клетки он активирует одни энзимы и ингибирует другие, таким образом, участвуя в регуляции клеточных функций. По сути, монооксид азота является локальным тканевым гормоном.
NO играет ключевую роль в подавлении активности бактериальных и опухолевых клеток путем либо блокирования некоторых их железосодержащих ферментов, либо путем повреждения их клеточных структур оксидом азота или свободными радикалами, образующимися из оксида азота. Одновременно в очаге воспаления накапливается супероксид О2Н, который вызывает повреждение белков и липидов клеточных мембран, что и объясняет его цитотоксическое действие на клетку-мишень.
NO, избыточно накапливаясь в клетке, может действовать двояко: с одной стороны вызывать повреждение ДНК и с другой — давать противовоспалительный эффект.
NO — токсичен, при вдыхании поражает дыхательные пути.
Вместе с тем NO способен инициировать образование кровеносных сосудов. В случае инфаркта миокарда оксид азота играет положительную роль, так как индуцирует новый сосудистый рост, но при раковых заболеваниях тот же самый процесс вызывает развитие опухолей, способствуя питанию и росту раковых клеток.
Повреждение ДНК под действием NO является одной из причин развития апоптоза (запрограммированный процесс клеточного «самоубийства», направленный на удаление клеток, утративших свои функции). В экспериментах наблюдалось дезаминирование дезоксинуклеозидов, дезоксинуклеотидов и неповрежденной ДНК при воздействии раствора, насыщенного NO. Этот процесс ответствен за повышение чувствительности клеток к алкилирующим агентам и ионизирующему излучению, что используется в антираковой терапии.
Очищение крови от NO происходит путем образования нитритов и нитратов и составляет в среднем не более 5 секунд. Этот процесс может включать промежуточные ступени, связанные со взаимодействием с супероксидом или с гемоглобином с образованием пероксинитрита.
В 1998 году трое американцев — Фурчготт, Игнарро и Мюрад — были удостоены премии Нобелевского комитета по физиологии «за открытия, касающиеся окиси азота как сигнальной молекулы в сердечно-сосудистой системе».
