
- •Взаимное влияние атомов в органических молекулах Электронные эффекты заместителей
- •Стереоизомерия
- •Кислотные свойства органических соединений
- •Пространственное строение органических молекул Конфигурация, конформация, хиральность
- •Олигосахариды
- •Свойства сахарозы
- •Физиологическая активность гетероциклических соединений, их строение и биологическая роль
- •Гидроксисоединения
- •Углеводы
- •Сахарные кислоты
- •Нуклеиновые кислоты
- •Липиды (жиры)
Гидроксисоединения
Гидроксисоединения – это вещества, которые в своём составе содержат гидроксильные группы. К ним относятся спирты, фенолы и другие классы органических соединений.
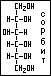
Спирты – это гидроксосоединения, в молекулах которых гидроксильные группы находятся у насыщенного атома углерода в состоянии sp3-гибридизации. Спирты классифицируют по количеству гидроксильных групп на одноатомные, содержащие 1 гидроксильную группу (этанол) и многоатомные, содержащие 2 и более гидроксильных групп (глицерин, сорбит). Сорбит применяется в качестве заменителя сахара.
Инозит – это структурный компонент липидов мозгового вещества.
![]()
![]()
В зависимости от характера звеньев, с которыми соединяются гидроксильные группы, спирты делятся на:
-
первичные, в которых гидроксильные группы находятся у первичного звена атома углерода, например: СН3-СН2-СН2-ОН (пропанол-1)
-
вторичные спирты – у которых гидроксильная группа соединяется со вторичным звеном атома углерода, например: пропанол-2.
![]()
-
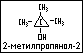
третичные спирты – в которых гидроксильные группы соединятся с третичным звеном атома углерода, например: 2-метилпропанол-2.
Химические свойства спиртов
– Реакции окисления спиртов. В организме окисление спиртов протекает в присутствии ферментов, которые называются дегидрогеназы. При этом происходит дегидрирование спиртов. Молекула спита теряет два атома водорода – это эквивалентно расщеплению двух протонов и двух электронов (2Н+ и 2е) или Н+ и одного гидрид-иона (II).
-
окисление первичных спиртов (пропанол-1 в пропаналь + НАДН + Н+ (гидр6).
-
окисление вторичных спиртов (пропанол-2 в ацетон + НАДН + Н+ (гидр7)
Таким образом, при окислении первичных спиртов образуются альдегиды, а вторичных – кетоны.
– Реакции нуклеофильного замещения (SN) в общем виде:
(субстрат + реагент + нуклеофил = продукт + уходящая группа нуклеофуг (гидр8)).
В ходе реакций нуклеофильного замещения атакующий реагент – нуклеофил отдаёт свою пару электронов субстрату, образуя продукт. Уходящая группа – нуклеофуг отделяется со своей парой электронов. Рассмотрим реакцию нуклеофильного замещения на примере хлорэтана из этанола (гидр9).
Поскольку гидроксильная группа (-ОН) в составе субстрата этанола является плохо уходящей группой, то прямое нуклеофильное замещение осуществить не удаётся. Поэтому гидроксильную группу в присутствии ионов Н+ переводят в кислую группировку, при этом образуется ион этилоксония, от которого отделяется молекула воды – хорошо уходящая группа. Реагент – нуклеофил Cl- с парой электронов присоединяется к атому углерода субстрата, образуя продукт – хлорэтан, который в медицинской практике используется для ингаляционного наркоза.
– Реакции
хелатообразования. Многоатомные спирты,
проявляя более выраженные кислотные
свойства, по сравнению с одноатомными
спиртами, вступая в реакцию с Cu(OH)2
(осадком голубого цвета в щелочной
среде) образуют растворимый хелатный
комплекс ярко-синего цвета – эта реакция
используется как качественная на
многоатомные спирты. При этом в молекула
многоатомных спиртов реагируют
гидроксильные группы
![]() -диольного
фрагмента, например:
-диольного
фрагмента, например:
![]() -диольный
фрагмент (гидр10).
-диольный
фрагмент (гидр10).
(2глицерина + Cu(OH)2 + 2ОН- = анионный хелатный комплекс глицерата меди (II) + 4воды (гидр11).
Фенолы
Фенолы – это гидроксосоединения, в молекулах которых гидроксильные группы соединяются с атомами углерода бензольного кольца. Фенолы классифицируют по количеству гидроксильных групп на:
-
одноатомные, содержащие одну гидроксильную группу, например: фенол.
-
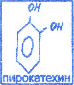
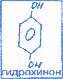
многоатомные, содержащие 2 и более гидроксильных групп. Многоатомные: пирокатехин в организме является структурным компонентом биологически активных соединений: резорцин используется для лечения кожных и инфекционных соединений: гидрохинон участвует в О/В процессах (пирокатехин, резорцин, гидрохинон).

Химические свойства фенолов
(гидрохинон в хинон (гидр15)).
Система хинон – гидрохинон в организме участвует в биологическом окислении.
–реакция электрофильного замещения (Sz)
(субстрат + реагент-электрофил = продукт + уходящая группа – электрофуг (гидр16)).
Рассмотрим механизм реакции электрофильного замещения в ароматическом ряду на примере нитрования бензола:
-
Образование реагента – электрофила HNO3+2H2SO4
 H3O++NO2-+2HSO4-
H3O++NO2-+2HSO4- -
Взаимодействие реагента – электрофила с бензолом (гидр17).
Образование
П-комплекса
реагента – электрофила и бензольного
кольца происходит за счёт пары электронов
сопряжённой системы. Преобразование
П-комплекса
в
![]() -комплекс
сопровождается нарушением ароматичности
и переходом атома углерода в состояние
sp3-гибридизации.
При отщеплении протона от
-комплекс
сопровождается нарушением ароматичности
и переходом атома углерода в состояние
sp3-гибридизации.
При отщеплении протона от
![]() -комплекса
ароматичность восстанавливается и
образуется производное бензола –
нитробензол. К реакциям электрофильного
замещения относятся реакции: нитрования,
сульфирования фенола. Рассмотрим
сульфирование фенола: (фенол + 3серной
кислоты = 2,4,6-трисульфофенол + 3воды
(гидр18)).
-комплекса
ароматичность восстанавливается и
образуется производное бензола –
нитробензол. К реакциям электрофильного
замещения относятся реакции: нитрования,
сульфирования фенола. Рассмотрим
сульфирование фенола: (фенол + 3серной
кислоты = 2,4,6-трисульфофенол + 3воды
(гидр18)).
Карбонильные соединения – это вещества, которые в своём составе содержат карбонильную группу >С=О.
В зависимости от характера связанных заместителей карбонильные соединения делятся на классы:
-
альдегиды (общая формула).
![]()
-
кетоны (общая формула).
![]()
-
карбоновые кислоты (общая формула).
![]()
Строение карбонильных групп (гидр22, 23).
В карбонильной группе атом углерода находится в состоянии sp2-гибридизации. Его конфигурация плоская: величина валентного угла составляет 1200: атом углерода соединён двумя ковалентными связями с атомом кислорода. Одна – сигма связь, другая – П-связь, возникающая за счёт перекрывания Р2-орбиталей атомов углерода и кислорода. П-связь является сильно поляризованной, её электронная плотность смещена к более электроотрицательному атому кислорода, на котором возникает частично отрицательный заряд, а на карбонильном атоме углерода – частично положительный заряд.
Альдегиды (гидр24).
В молекуле альдегидов выделяют следующие реакционные центры:
-
основной нуклеофильный центр
-
электрофильный центр
-
СН-кислотный центр
Химические свойства альдегидов
–реакции нуклеофильного замещения (АN). Альдегиды и кетоны вступают в реакции нуклеофильного присоединения при взаимодействии со спиртами R-OH, аминами R-NH3, тиолами R-SH, синильной кислотой HCN, аммиаком NH3. в ходе реакций нуклеофильного присоединения происходит разрыв П-связи в карбонильной группе. К карбонильному атому углерода присоединяется реагент – нуклеофил, а к атому кислорода – нуклеофильная частица.
(пропаналь + метанол = полуацеталь (1-метоксипропанол-1) (гидр25)).
Протекает в избытке спирта по типу реакций этерификации.
(полуацеталь + метанол = ацеталь (1,1-диметоксипропан) + вода (гидр26)).
Ацетали и полуацетали имеют важное биологическое значение. В виде цикла полуацетали в организме присутствуют как углеводороды. Реакции образования ацеталей лежат в основе получения природных полисахаридов: крахмал и др.
–Реакции окисления альдегидов
(этаналь
+ 2Cu(OH)3
![]() “этановая кислота” + 2CuОН
+ вода (гидр27))
“этановая кислота” + 2CuОН
+ вода (гидр27))
2CuОН
![]() Cu2О
Cu2О![]() + Н2О
+ Н2О
Оксид Cu2O выпадает в виде осадка кирпично-красного цвета.
Альдегиды при взаимодействии с мягкими окислителями, например Cu(ОН)2, при нагревании окисляются до карбоновых кислот. Реакция при этом сопровождается образованием оксида меди (I) Cu2О – осадка красно-коричневого цвета. Эта реакция используется как качественная на альдегидные группы.
–Реакции конденсации. В ходе этих реакций происходит усложнение углеродной цепи. Рассмотрим конденсацию альдегида – пропаналя (гидр28). Различают альдегидную конденсацию, протекающую в присутствии разбавленных растворов щёлочи, и протоновую конденсацию, протекающую в присутствии кислот в более жёстких условиях. В случае протоновой конденсации от образующего конденсата (альдоля) отщепляется молекула воды и образуется непредельный альдегид (гидр29). В организме конденсация альдегидов протекает с участием ферментов, которые называются альдолаты.
Карбоновые кислоты – это вещества, которые в своём составе содержат карбоксильную группу (СООН (гидр30)).
Карбоновые кислоты классифицируют по количеству карбоксильных групп на:
-
одноосновные или многокарбоновые кислоты, содержащую одну карбоксильную группу: НСООН – муравьиная кислота (метановая); СН3СООН – уксусная кислота (этановая); СН3СН2СООН – пропионовая кислота (пропановая); СН3(СН2)2СООН – масляная кислота (бутановая); СН3(СН2)3СООН – валериановая (пентановая); СН3(СН2)4СООН – капроновая (гексановая).
-
поликарбоновые кислоты, содержащие 2 и более карбоксильные группы:
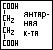
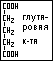
Предельные дикарбоновые кислоты: щавелевая (этандиовая) кислота, соли – оксалаты; малоновая (пропандиовая) кислота, соли – малоцаты; янтарная (бутандиовая) кислота, соли – сукцинаты; глутаровая (пентандиовая) кислота, соли – глутараты.
Непредельная бутендиовая кислота НООС-СН=СН-СООН.
![]()
![]()
В зависимости от наличия младших функциональных групп кислоты делятся на:
-
гидроксикислоты, содержащие группу –ОН:
-
молочная кислота, соли – лактаты
-
яблочная кислота, соли – малаты
-
лимонная кислота, соли – цитраты
-
салициловая кислота
(гидр 35,36,37,38)
-
кетонокислоты – это кислоты содержащие карбонильную группу –С=О.
-
пировиноградная кислота (ПВК), соли – пируваты
-
щавелево-уксусная кислота (ЩУК), соли – соли ЩУК
-
ацето-уксусная кислота , соли – соли ацето-уксусной кислоты
![]()
![]()
![]()
Особо выделяют группу высших жирных карбоновых кислот, входящих в состав липидов:
-
предельные высшие жирные кислоты:
С17Н35СООН – стеариновая кислота
С15Н31СООН – пальмитиновая кислота
С23Н47СООН – лигноцериновая кислота
![]()
-
непредельные высшие жирные кислоты:
С17Н33СООН – олеиновая кислота
С17Н31СООН – линолевая кислота
С17Н29СООН – линоленовая кислота
С23Н45СООН – нервоновая кислота
Строение кабоксильной группы: (гидр 43)
Карбоксильная группа представляет собой плоскую сопряжённую систему, в которой возникает р,П-сопряжение при взаимодействии рz-орбитали атома кислорода гидроксогруппы с П-связью. Наличие р,П-сопряжения в карбоксильной группе карбоновых кислот способствует равномерному распределению отрицательног заряда в ацилат–ионе, образующемся при отщеплении протонов. (гидр44)
Равномерное распределение отрицательного заряда в ацилат-ионе показывают следующим образом (гидр45)
Наличие р,П-сопряжения в карбоксильной группе карбоновых кислот значительно повышает кислотные свойства карбоновых кислот по сравнению со спиртами.
С2Н5ОН рКа=18
СН3СООН рКа=4,76
В карбоновых кислотах частичный положительный заряд на карбонильном атоме углерода меньше, чем в альдегидах и кетонах, поэтому кислота менее активна к восприятию атаки нуклеофильного реагента. Соответственно, реакции нуклеофильного присоединения более характерны для альдегилов и кетннов.
R-COOH
R – гидрофобная часть молекулы
СООН – гидрофильная часть молекулы.
С увеличением длины углеводородногог радикала понижается растворимость кислот, степень гидротированности и стабильность ацилат-аниона. Это приводит к уменьшению силы карбоновых кислот. В карбоновых кислотах выделяют слдующие реакционные центры: (Гидр46)
1. основный нуклеофильный центр
2. электрофильный центр
-
ОН – кислотный центр
-
СН – кислотный центр
Химические свойства карбоновых кислот:
-
реакции диссоциации
(карб. к-та + вода = ацилат-ион + Н3О (гидр47)
-
реакции галогенирования (реакции в СН – кислотном центре)
(пропионовая
кислота + Br2
=
![]() -бромпропионовая
+ HBr
)(гидр48)
-бромпропионовая
+ HBr
)(гидр48)
-
реакции декарбоксилирования – реакции,Ю в ходе которых поисходит удаление углекислого газа из карбоксильной группы, приводящее к разрушению карбоксильной группы.
In vitro реакции декарбоксилирования протекают при нагревании; in vivo – с участием ферментов – декарбоксилаз.
-
(пропионовая кислота = угл. газ + этан) (гидр 49)
-
в организме декарбоксилирование дикарбоновых кислот протекает ступенчато: (янткарная = пропионовая + угл. газ = этан + угл. газ)(гидр50)
-
в организме также протекает окислительное декарбоксилирование, в частности, ПВК в митохондриях. С участием декарбоксилазы, дегидрогеназы и кофермента А (HS-KoA). (ПВК = этаналь + угл. газ = ацетил-KoA + НАДН + Н-.) (гидр51). Ацетил-КоА будучи активным соединением, вовлекается в цикл Кребси.
реакции этерификации – нуклеофильного замещения (SN) у sp2-гибридизованного атома углерода. (уксусная кислота + метанол = метилацетат (гидр52)). Механизм реукции нуклеофильного замещения (гидр 53)
реакции окисления. Рассмотрим на примере гидроксокислот. Окисление гидроксокислот протекает аналогично окислению вторичных спиртов с участием ферментов – дегидрогеназ.
-
(молочная = ПВК + НАДН + Н+) гидр 54
-
(
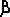 -гидроксимасляная
= ацетоуксусная + НАДН + Н+)
гидр 55Таким образом, при окислениии
гидроксокислот с участием ферментов
– дегидрогеназ образуются кетокислоты.
-гидроксимасляная
= ацетоуксусная + НАДН + Н+)
гидр 55Таким образом, при окислениии
гидроксокислот с участием ферментов
– дегидрогеназ образуются кетокислоты.
Пути превращения ацетоуксусной кислоты в организме:
В норме она подвергается гидролитическому расщеплению с участием фермента гидролазы, при этом образуются 2 молекулы уксусной кислоты.
![]()
При патологии фцетоуксусная кислота декарбоксилируется с образованием ацетона.
![]()
Кетоновые тела накапливаются в крови больных сахарным диабетом, обнаруживаются в моче, они токсичны, особенно для нервной системы.
Медикобиологическое значение карбоновых кислот.
Салициловая
кислота
 и фарм препараты на её основе в медицинской
практике используются наружно при
кожных заболеваниях в качестве
отвлекающего и антисептического
средства. Внутрь салициловая кислота
не применяется, т.к. обладает выраженными
кислотными свойствами (рКа=2,98).
При приёме внутрь она может вызвать
раздражение пищеварительного тракта.
На основе салициловой кислоты готовят
фармпрепараты:
и фарм препараты на её основе в медицинской
практике используются наружно при
кожных заболеваниях в качестве
отвлекающего и антисептического
средства. Внутрь салициловая кислота
не применяется, т.к. обладает выраженными
кислотными свойствами (рКа=2,98).
При приёме внутрь она может вызвать
раздражение пищеварительного тракта.
На основе салициловой кислоты готовят
фармпрепараты:
-
салицилат натрия.
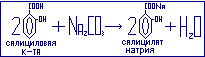 Применяется внутрь, как жаропонижающее
и противовоспалительное средство.
Применяется внутрь, как жаропонижающее
и противовоспалительное средство. -
фенолсалицилат (салол) гидр 60 Салол в медицине применяется внутрь, как антисептик при заболеваниях кишечника (колитах) и мочевыводящих путей (циститах). Салол примечателен тем, что в кислой среде желудка он не гидролизуется и распадается только в кишечнике, поэтому применяется для изготовления оболочек лекарственных препаратов.
-
метилсалицилат (гидр61). В медицинской практике применяется наружно при артритах и радикулитах в качестве обезболивающего и противовоспалительного средства.
-
ацетилсалициловая кислота (аспирин) гидр62. Применяется внутрь, как жаропонижающее, обезболвающее и противовоспалительное средство.
-
пара-аминосалициловая кислота (ПАСК).
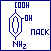 обладает противотуберкулёзным действием.
В медицинской практике обычно используется
в виде натриевой соли – парааминсалицилата
натрия.
обладает противотуберкулёзным действием.
В медицинской практике обычно используется
в виде натриевой соли – парааминсалицилата
натрия.
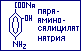
Структурный
изомер парааминсалициловой кислоты –
метааминосалициловая
кислота
![]() высокотоксична
и в качестве лекарственных препаратов
не используется.
высокотоксична
и в качестве лекарственных препаратов
не используется.
НСООН – при попадании на кожу вызывает ожог – в медицинской практике используется наружно, в виде спиртовых растворов при ревматических болезнях.
СН3СООК – ацетат калия, пименяется для лечения отёков.
![]()
(СН3СОО)2Pb*3Н2О – тригидрат ацетата свинца; СН3СООPbОН – основной ацетат свинца. Эти препараты применяются наружно в качестве вяжущих стедств при воспалительных процессах кожи и слизистых оболочек.
Изовалериановая кислота – содержится в корнях валерианы, входит в состав валидола.
![]()
СаС2О4 – оксолат кальция – в организме участвует в образовании камней в почках и мочевом пузыре.
Дикарбоновые кислоты:
Янтарная
![]() и глутаровая
и глутаровая
 лежат в основе биологически важных
лежат в основе биологически важных
![]() -аминокислот:
аспаргиновой и глутаминовой.
-аминокислот:
аспаргиновой и глутаминовой.
Молочная
кислота
![]() образуется в результате молочнокислого
брожения углеводов, например: глюкозы.
образуется в результате молочнокислого
брожения углеводов, например: глюкозы.
![]()
Молочная кислота содержится в кисломолочных продуктах, квашеной капусте, солёных овощах. Молочная кислота обнаруживается в желудочном содержимом при пониженной кислотности желудка. В норме в желудочном соке молочной кислоты быть не должно.
Соль молочной кислоты – лактат кальция – в медицинской практике используется при аллергических кожных заболеваниях, воспалениях, переломах, кровотечениях, а так же в качестве противоядия при отравлениях щавелевой кислотой и другими веществами.
![]()
Яблочная кислота (гидр73) содержится в яблоках, рябине, фруктовых соках в организме участвует в обменных процессах. Лимонная кислота (гидр74) – содержится в цитрусовых, винограде, крыжовнике. Её соль – цитрат натрия – используется в медицине, как консервант крови.
