
1.3. Плавление
Плавление это переход вещества из твердого кристаллического состояния в жидкое при нагревании. Плавление является фазовым переходом первого рода, который происходит с поглощением теплоты. Главными характеристиками такого перехода чистых веществ являются температура и энтальпия плавления. Если состав плавящегося вещества не изменяется, плавление называется конгруэнтным, если изменяется - ин конгруэнтным.
Плавлению предшествуют интенсивное разупорядочивание кристаллов вещества и проявление жидких микроучастков на поверхности кристаллов и вблизи межкристаллитных границ. По мере нагревания микроучастки укрупняются и сливаются, формируя жидкую фазу, а кристаллы рассыпаются на фрагменты и уменьшаются в размерах до полного исчезновения. Теплота, подводимая к веществу при плавлении, расходуется в основном на разрыв межатомных связей, а не на его нагревание. Поэтому чистые крупнокристаллические вещества в течение плавления не изменяют свою температуру (рис.4.). Для таких веществ температура плавления служит идентифицирующей характеристикой и критерием их чистоты. Плавление веществ со сходной кристаллической структурой описывается эмпирически формулой Линдемана:
![]() ,
,
где Тпл - температура плавления; А - постоянная для группы веществ; M и V – молекулярная масса и объем веществ; - температура Дебая.
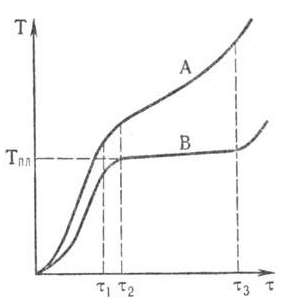
Рис.4. Изменение температуры (Т) при нагревании чистого вещества (А) и твердого раствора (В) в течение времени τ при постоянной интенсивности подвода теплоты. При τ < τ1 происходит нагревание вещества, в интервале времени от τ1 до τ2 – предплавление, при τ > τ3 – нагревание расплава.
1.4. Инверсия
Инверсией в химии называется изменение конформации циклической молекулы, в результате чего меняется ориентация заместителя относительно кольца. Например, метилциклогексан существует в виде равновесной смеси двух конформаций с преобладанием формы II:

Рис. . Пример инверсии
Частота инверсии зависит от характера заместителей и температуры
Также инверсией называют переход конфигурации молекулы, содержащей трёхвалентный «пирамидальный» атом (например, азота или мышьяка), в зеркально противоположную.
1.5. Эвтектика
Эвтектика это нонвариантная (при постоянном давлении) точка в системе из n компонентов, в которой находятся в равновесии n твердых фаз и жидкая фаза. Эвтектическая композиция представляет собой мелкодисперсную механическую смесь фаз, плавящихся и кристаллизующихся одновременно при минимальной температуре существования жидкой фазы для данной системы.

Рис. . Бинарная фазовая диаграмма с эвтектическим превращением
Добавляя или отводя тепло, можно изменить пропорцию между кристаллическими фазами и расплавом в эвтектической точке без изменения температуры. После кристаллизации эвтектика становится механической смесью фаз — твёрдой эвтектикой.
Эвтектика является пересечением поверхностей насыщения участвующих кристаллических фаз, находящихся в равновесии с расплавом при минимальной температуре плавления. Если отводится соответствующее количество тепла, то расплав эвтектического состава при кристаллизации в равновесных условиях в точке эвтектики даст все кристаллические фазы, участвующие в системе. Если же при сохранении эвтектической температуры в достаточном количестве подводится тепло, то смесь фаз, отвечающая эвтектическому составу, в равновесных условиях полностью расплавится.
Методы консервирования клеточных суспензий
Криоконсервирование
Криоконсервированием называют процесс хранения органов, тканей или отдельных клеток при температуре кипения жидкого азота или в парах азота.
Низкотемпературное консервирование – многоэтапный и многофакторный процесс, в течение которого биологические объекты подвергаются действию различных физико-химических факторов, обусловленных изменениями температуры, состава и состояния компонентов системы. Для достижения цели применяются искусственные среды – криоконсерванты, в состав которых входят специальные защитные средства – криопротекторы.
Криопротекторы — вещества, защищающие живые объекты от повреждающего действия замораживания. Криопротектор играет роль клеточного «антифриза»: с одной стороны он заменяет воду в качестве растворителя, уменьшая объемную долю консервированной соли, с другой стороны криопротектор способствует увеличению вязкости воды и уменьшению вероятности кристаллизации. В настоящее время все криозащитные вещества условно разделены на две основные группы: на вещества эндо- (криопротектор проникает через клеточную мембрану в клетку) и экстрацеллюлярного (криопротектор не проникает через клеточную мембрану) механизма действия. Следует выделить также третий класс криопротекторов, которые обладают смешанным эффектом действия.
Криопротектор должен обладать следующими свойствами:
-
Дегидратационными;
-
Способностью легко проникать в ткани;
-
Относительно низкой токсичностью;
-
Эффективно связывать воду;
-
Низкой эвтектической температурой.
Защитные свойства криопротектора в основном зависят от его способности образовывать водородные связи с жидкой фазой клетки за счет большого количества неспаренных электронов, обладающих большой химической реакционной способностью.
В зависимости от эффективности криозащиты (без количественного выражения последней) криопроекторы делятся на:
1. Эффективные криопротекоры для одного и более типов клеток: полигидроксисоединения (гликоли, глицерин, амиды, моносахариды) диметилсульфоксид (ДМСО), пиридин, полимеры, окиси этилена, декстрин и др.
2. Умеренные и слабые криопротекотры для одного и более типов клеток: алкоголи, карбоксильные и гидрооксикислоты, глицеромонацетат, мочевина, неорганические соли, альбумин и т.д.
Криопротекторами не являются фенолы, кетоны, диметилсульфон, диоксан и т.д. Для криопротекторов разной химической природы нет единых границ молекулярной массы. Криопротекторами являются и низкомолекулярные соединения (глицерин, ДМСО), и полимеры.
Свойства криопротекторов в процессе замораживания биологических структур реализуются следующим образом. В присутствии криопротектора вымораживание фракции воды из криозащитной среды протекает в широкой темрпературной зоне и завершается, когда концентрация невымерзшей воды достигает величины 20 – 30 %. Увеличение исходной (до замораживания) концентрации криопротектора приводит к снижению роста концентрации вне – и внутриклеточных солей. В присутствии криопротекторов соли либо вообще не концентрируются до повреждающих пределов, либо эти пределы достигаются в зоне температур, когда развитие повреждений протекает медленно.
Возникающие при вымораживании воды из криозащитных сред гипертонические (не достигшие повреждающего предела) концентрации криопротектора вызывают обезвоживание клеток, что, в свою очередь, повышает концентрацию внутриклеточной среды.
Быстрое проникновение книопротектора в клетку предотвращает ее повреждение в гипертонических криозащитных средах и по мере вымораживания воды на фоне обезвоживания клеток предупреждает возникновение на мембране повреждающих градиентов концентраций вне- и внутриклеточного раствора.
Несмотря на то, что проникающие криопротекторы, как правило, обеспечивают более эффективную защиту биологических структур при вымораживании воды, чем не проникающие, их применение зачастую наталкивается на ряд серьезных трудностей, связанных с возвращением клеток в изотоническую среду. Следует отметить, что высокая проницаемость криопротектора через плазматическую мембрану отнюдь не подразумевает столь же высокую его проницаемость через мембраны органелл, которые могут повреждаться в результате повышения концентрации криопротектора в клетке.
Одним из наиболее важных факторов криоповрежедния при кристаллизации клеточной суспензии является повышение концентрации растворенных веществ в окружающей клетку жидкой фазе. Основной составной частью физиологической среды, в которой находятся клетки в норме, является 0.15 М водяной раствор NaCl. Также необратимые изменения вызывающие повреждения клеток в процессе низкотемпературного воздействия, связаны с образованием дисульфидных мостиков между соседними белками или отдельными участками одной молекулы путем окисления SH- групп. Это происходит в процессе обезвоживания клеток и возникающей деформации их мембран: увеличивается концентрация белков, например ферментов, или происходит соприкосновение мембранных структур, которые в нормальном состоянии отдалены друг от друга.
Температурным (холодовым) шоком называется явление повреждения клеток при быстром охлаждении в области положительных температур. Ему подвержены сперматозоиды, бактерии, эмбрионы, гранулоциты, некоторые клетки высших растений и эритроциты.
Возвращение клеток в изотонический раствор после контакта с гипертоническим раствором часто приводит к разрушению их мембран (постгипертонический лизис). Одна из его физических причин заключается в следующем. Если в гипертонической среде внутрь клеток проникает достаточно большое количество растворенных веществ, то при переносе в изотонический раствор внутрь клеток должно проникнуть значительно больше воды, чем ее было удалено на стадии обезвоживания (прежде, чем концентрация растворенных внутри клеток веществ уменьшится до изотонической). При этом мембраны растягиваются до такой степени, что наступает их механическое разрушение или нарушение их барьерно– транспортной функции. Отогрев замороженной суспензии также приводит к резкому уменьшению концентрации растворенных веществ во внеклеточной среде за счет таянья льда.
Одна из наиболее ранних гипотез о повреждении биологических структур при замораживании была выдвинута в работах Максимова (1913) на основе интуитивного представления о механическом повреждении растущими кристаллами льда. Такое повреждение может быть связано с деформацией и разрывом цитоплазматических мембран, нарушением межклеточных контактов, деструкцией нормальной пространственной организации внутри клеток. Механическое повреждение клетки происходит также во время рекристализационного укрупнения внутриклеточного льда при отогреве. Поэтому при быстром отогреве сохранность многих видов предварительно замороженных клеток выше, чем при медленном, поскольку снижается время пребывания образца в зоне рекристаллизации.
Физиологические основы криоконсервирования клеток
В процессе замораживания клеток необходимо выделить следующие методические этапы:
1. Приготовление клеточных суспензий (например, выделение необходимых клеток крови, сперматозоидов, яйцеклеток).
2. Подготовка клеточных суспензий к консервации (например, добавление криопротекторов).
3. Собственно замораживание.
4. Хранение криоконсервированных клеток в специальных емкостях при определенных температурах. По диапазонам температур выделяют следующие этапы криоконсервации клеток.
1. От -37 до -25 °С - зона температурного оптимума биологической активности.
2. От -25 до -10 °С - зона перехода клеток в состояние неполного анабиоза (временное прекращение или торможение метаболических процессов, «переохлаждение» клеточных суспензий без кристаллизации воды).
3. От -10 до -80 °С - зона кристаллизации охлажденной и переохлажденной окружающей клетку и внутриклеточной воды и перехода клетки в состояние полного анабиоза.
4. От -80 до -130 °С - зона кристаллизации связанной и адсорбированной воды и рекристаллизации.
5. От -130 до -273 °С - зона отсутствия кристаллизации и рекристаллизации.
Применяют два основных метода замораживания:
1. Неконтролируемое, или ручное замораживание, когда сосуд с суспензией клеток в смеси с криопротектором помещают в морозильную камеру (-80 °С) или в пары жидкого азота (-130°С) - замораживание происходит со скоростью примерно 1-3 °С в мин;
2. Контролируемое, или программное замораживание, при котором клеточные суспензии охлаждают с помощью специальных приборов - программных замораживателей.
Такой способ позволяет достичь наилучших результатов. Замороженные клетки хранят в электрических морозильных камерах при температуре от -80 до -130 °С или в сосудах Дьюара : жидким азотом при температуре -196 °С. Чем ниже температура в хранилище, тем дольше можно сохранить жизнеспособные клетки. Хотя при температуре ниже -150 °С существенной разницы уже не наблюдается, так как метаболические и кристаллизационные процессы в клетках не происходят.
Материалы и методы
Объект исследования
Экстракты выделяли из ткани плаценты человека, которая тестировалась на наличие вирусных инфекций. Для получения экстрактов отмытые фрагменты гомогенизировали, добавляя 0,15 М NaCl в соотношении 1:1. через 12 ч эквилибрации их центрифугировали и собирали надосадок для исследований. Экстракты хранили в течении 6 месяцев при температуре -20 и -80ОС в морозильных камерах с соответствующей температурой, при -196 ОС в сосуде с жидким азотом. Экстракты размораживали в водяной бане при 22 ОС. Гель-хроматографию экстрактов проводили на колонке 21*2 см с крупнопористой матрицей сефадекс G-200. Область фракционирования для данной матрицы 5 – 250 дальтон, удельный объем упакованных гранул на 1 гр. сухого сефадекса 20 – 25.
Концентрацию белка определяли спектрометрическим методом, концентрацию продуктов перекисного окисления – с помощью реакции с тиобарбитуровой кислотой. Эритроциты получали из донорской крови. Экспозиция эритроцтов с экстрактами плаценты или отдельными фракциями, полученными методом гель-хроматографии составляла 2 ч. Для этого эритромассу разводили в соотношении 1:1 физиологическим раствором и соединяли с равным количеством экстракта. Осмотическую хрупкость эритроциров оценивали по уровню гемолиза. Для определения гемолиза концентрацию гемоглобина измеряли спектрофотометрическим методом.
Получение фракций экстрактов плаценты человека с помощью гель-фильтрации
Экстракты плазмы получали с помощью гель - фильтрации.
В процессе гель - фильтрации молекулы фракционируемых веществ не должны обладать никаким специальным сродством к неподвижной или подвижной фазе. Неподвижная фаза здесь представлена жидкостью, находящейся внутри пористых гранул, - точно такой же, как и жидкость подвижной фазы, протекающей между ними. Благодаря силам сцепления с поверхностью пространственной сетки полимера или иного пористого материала, образующего гранулы, жидкость внутри них остается неподвижной и не увлекается течением подвижной фазы.
Переход молекул вещества из подвижной фазы в неподвижную и обратно за счет диффузии ничем не затруднен. Иная ситуация складывается внутри гранул. Здесь диффузия более или менее затруднена из-за столкновений молекул диффундирующего вещества с нитями пространственной сетки полимера или стенками пор. Если размеряя молекул соизмеримы со средним диаметром каналов в гранулах, то эти затруднения становятся весьма существенными и диффузия тормозится.
Гель-хроматография (гель-фильтрация) - метод разделения смесей веществ с различными молекулярными массами путем фильтрации анализируемого раствора через поперечно-сшитые ячеистые гели.
Неподвижная фаза при гель-фильтрации представлена жидкостью, находящейся внутри пористых, хорошо смачиваемых гранул, заполняющих хроматографическую колонку. Если на такую колонку подается растворенная в элюенте смесь молекул различных размеров, то крупные молекулы, неспособные проникнуть внутрь гранул, будут продвигаться вдоль колонки вместе с подвижной фазой. В то же время наиболее мелкие молекулы, размеры которых заведомо меньше диаметра пор в гранулах, будут равномерно распределяться между подвижной и неподвижной фазами. Для них будет осуществляться хроматографический процесс с присущим ему замедлением миграции хроматографической зоны. Для молекул промежуточной величины благодаря статистическому распределению размеров пор окажется доступной только часть объема неподвижной фазы. Зона или зоны таких молекул будут мигрировать вдоль колонки быстрее, чем мелкие молекулы, но медленнее, чем крупные. В результате произойдет фракционирование исходной смеси молекул на зоны в зависимости от их размеров. Зоны выходят из колонки в порядке убывания этих размеров, что показано на рис..

Рис.. Принцип гель-фильтрации (кружки – гранулы пористой матрицы; черные точки, разных размеров – компоненты смеси веществ). а – момент внесения смеси на колонку, б – начало фракционирования, в – начало выхода из колонки фракции наиболее крупных молекул.
В простейшем случае, когда в исходной смеси содержатся только молекулы двух категорий (крупные и мелкие), гель-фильтрация позволяет осуществить «сортировку» этих молекул. В частности, таким образом проводят обессоливание растворов биополимеров и очистку макромолекул от сопутствующих им низкомолекулярных компонентов. Смесь молекул нескольких промежуточных размеров в ходе гель-фильтрации разделяется на ряд дискретных групп, различающихся между собой по степени доступности для них объема внутри гранул. Соответствующие хроматографические зоны мигрируют с различными скоростями и выходят из колонки в виде разделившихся пиков.
Методы исследования и используемая аппаратура
