
1.2. Кристаллизация
Кристаллизацией называют переход вещества из газообразного, жидкого или твердого аморфного состояния в кристаллическое, а также переход из одного кристаллического состояния в другое (рекристаллизация, или вторичная кристаллизация). Кристаллизация является фазовым переходом первого рода. Кристаллизация из жидкой или газовой фазы - экзотермический процесс, при котором выделяется теплота фазового перехода, или теплота кристаллизации; при этом изменение энтропии в большинстве случаев составляет [в Дж/(моль.К)]: для простых веществ 5-12, для неорганических соединений 20 - 30, для органических соединений 40-60. Рекристаллизация может протекать с выделением либо поглощением теплоты. В промышленности и лабораторной практике кристаллизацию используют для получения продуктов с заданными составом, содержанием примесей, размерами, формой и дефектностью кристаллов, а также для фракционного разделения смесей и др.
Условия, при которых возможна кристаллизация, определяются видом диаграммы состояния. Чтобы кристаллизация протекала с конечной скоростью, исходную фазу необходимо переохладить (перегреть), пересытить кристаллизующимся веществом или внести во внешнее поле, снижающее растворимость кристаллизующейся фазы. В переохлажденной (перегретой) либо пересыщенной фазе происходит зарождение новой фазы - образуются центры кристаллизации, которые превращаются в кристаллы и растут, как правило, изменяя форму, содержание примесей и дефектность. Центры кристаллизации возникают гомогенно в объеме начальной фазы и гетерогенно на поверхностях посторонних твердых частиц (первичное зародышеобразование), а также вблизи поверхности ранее сформировавшихся кристаллов новой фазы (вторичное зародышеобразование).

Рис. I Зависимость скорости зародышеобразования от переохлаждения расплава InSb: I расплав массой 16 г перегревался в кварцевом тигле на 15 К выше температуры плавления в течение 9 мин и затем охлаждался со скоростью 1 град/мин; 2 то же, на 55 К в течение 20 с.
Равновесное состояние системы при постоянной температуре и объеме можно
охарактеризовать минимумом свободной энергии Гельмгольца
![]() где
где
![]()
− внутренняя
энергия, равная сумме энергии связи
частиц
![]() и
тепловой энергии, определяемой
температурой T и теплоемкостью
и
тепловой энергии, определяемой
температурой T и теплоемкостью
![]() .
.
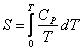
– энтропия системы.
Внутренняя энергия
U и энтропия S с повышением температуры
растут и при температуре плавления
![]() ,
испытывают скачки, обусловленные
теплотой плавления Q. Ее наличие
показывает, что речь идет о фазовом
переходе I рода.
,
испытывают скачки, обусловленные
теплотой плавления Q. Ее наличие
показывает, что речь идет о фазовом
переходе I рода.
Кривые солидуса s и ликвидуса l (рис.2.) для свободной энергии твердого тела и жидкой фазы убывают из-за влияния энтропийного члена. Для жидкой фазы скорость убывания больше, чем для твердой, за счет того, что степень неупорядоченности жидкости больше, чем у твердого тела. Поэтому ниже точки пересечения кривых s и l устойчива твердая фаза, а выше – жидкая. Точка пересечения не является особой точкой, поэтому возможны переохлаждение расплава и перегрев кристалла.
|
|
|
Рис.2. Вид зависимости свободной энергии от температуры для твердой – S и жидкой – l фаз |
При температуре
![]() в
равновесии находятся две фазы: расплав
и кристалл. При температуре
в
равновесии находятся две фазы: расплав
и кристалл. При температуре
![]() идет
фазовое превращение расплава в кристалл.
Переохлаждение на величину
идет
фазовое превращение расплава в кристалл.
Переохлаждение на величину
![]() (степень
переохлаждения) приводит к тому, что
расплав становится метастабильной по
отношению к кристаллу. Для начала
спонтанного процесса кристаллизации
необходимо возникновение центра
кристаллизации, или кристаллического
зародыша.
(степень
переохлаждения) приводит к тому, что
расплав становится метастабильной по
отношению к кристаллу. Для начала
спонтанного процесса кристаллизации
необходимо возникновение центра
кристаллизации, или кристаллического
зародыша.
Кинетика кристаллизации
При охлаждении расплава до температуры кристаллизации переход в твердое состояние происходит не мгновенно и не одновременно во всем объеме. Кристаллизация развивается из одного или нескольких центров и распространяется с конечной скоростью, захватывая постепенно весь объем неустойчивой фазы. Кинетика процесса кристаллизации описывается двумя величинами:
• скоростью образования центров кристаллизации С в единице объема за единицу времени;
• линейной скоростью
роста
![]() кристалла, равной скорости перемещения
растущей грани кристалла по нормали
к этой грани.
кристалла, равной скорости перемещения
растущей грани кристалла по нормали
к этой грани.
Кривые
![]() и
и
![]() имеют
максимумы, что объясняется тем, что при
малых степенях переохлаждения ΔТ
наблюдается возрастание скорости роста
кристалла
имеют
максимумы, что объясняется тем, что при
малых степенях переохлаждения ΔТ
наблюдается возрастание скорости роста
кристалла
![]() и
скорости образования центров кристаллизации
С, а при больших степенях переохлаждения
ΔТ, в результате роста вязкости, – их
падение.
и
скорости образования центров кристаллизации
С, а при больших степенях переохлаждения
ΔТ, в результате роста вязкости, – их
падение.
Часто максимумы
![]() и С довольно сильно сдвинуты относительно
друг друга по шкале температур (рис. 3).
При этом центры кристаллизации в области
максимума скорости роста еще не
образуются, а в области максимума
скорости образования центров кристаллизации
линейная скорость роста уже мала. Это
тормозит суммарную скорость кристаллизации,
и полное время этого процесса растет.
и С довольно сильно сдвинуты относительно
друг друга по шкале температур (рис. 3).
При этом центры кристаллизации в области
максимума скорости роста еще не
образуются, а в области максимума
скорости образования центров кристаллизации
линейная скорость роста уже мала. Это
тормозит суммарную скорость кристаллизации,
и полное время этого процесса растет.

Рис. 3. Кривые линейной скорости роста и скорости образования центров кристаллизации

