
- •Министерство образования и науки Российской Федерации
- •Научный редактор
- •Введение
- •1. Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.1. Задачи
- •1.2. Контрольные вопросы
- •2. Законы и уравнения состояния идеальных газов. Смеси идеальных газов
- •2.1. Задачи
- •2.2. Контрольные вопросы
- •3. Теплоемкости газов и газовых смесей
- •3.1. Задачи
- •3.2. Контрольные вопросы
- •4. Первый закон термодинамики для закрытой системы
- •4.1. Задачи
- •4.2. Контрольные вопросы
- •5. Политропные процессы изменения состояния идеальных газов
- •5.1. Задачи
- •5.2. Особенности расчета процессов идеальных газов при учете влияния температуры на их изобарную и изохорную теплоемкости
- •5.3. Задачи
- •5.4. Контрольные вопросы
- •6. Термодинамические свойства воды и водяного пара. Процессы водяного пара
- •6.1. Задачи
- •6.2. Контрольные вопросы
- •7. Влажный воздух
- •Основные характеристики влажного воздуха
- •Характеристики атмосферного влажного воздуха
- •Область влажного ненасыщенного воздуха h,d- диаграммы
- •Область перенасыщенного влажного воздуха h,d- диаграммы
- •Пример пользования h,d- диаграммой
- •7.1. Задачи
- •7.2. Контрольные вопросы
- •8. Второй закон термодинамики
- •8.1. Задачи
- •8.2. Контрольные вопросы
- •9. Первый закон термодинамики для потока. Работа изменения давления в потоке. Эксергия в потоке
- •Работа изменения давления в потоке для адиабатных процессов
- •Эксергия в потоке
- •9.1. Задачи
- •9.2. Контрольные вопросы
- •10. Истечение газа и пара через сопловые каналы
- •Особенности расчета процесса истечения через сопло реальных веществ
- •Необратимое истечение газов и паров через сопло
- •Процессы торможения. Параметры заторможенного потока
- •Методика расчета соплового канала при истечении через него газа или пара с начальной скоростью больше нуля
- •10.1. Задачи
- •10.2. Контрольные вопросы
- •11. Дросселирование газов, паров и жидкостей
- •11.1. Задачи
- •11.2. Контрольные вопросы
- •12. Процессы смешения газов и паров
- •Смешение в объёме
- •Смешение в потоке
- •Смешение при заполнении объёма
- •12.1. Задачи
- •12.2. Контрольные вопросы
- •13. Циклы двигателей внутреннего сгорания
- •Цикл двс с подводом теплоты к рабочему телу при постоянном объеме
- •Цикл двс с подводом теплоты к рабочему телу при постоянном давлении
- •Цикл двс со смешанным подводом теплоты к рабочему телу
- •13.1. Задачи
- •13.2. Контрольные вопросы
- •14. Циклы воздушных реактивных двигателей
- •Цикл прямоточного врд
- •Цикл турбокомпрессорного врд
- •14.1. Задачи
- •14.2. Контрольные вопросы
- •15. Циклы газотурбинных установок
- •Методика расчета тепловой экономичности обратимого цикла гту
- •Тепловая экономичность реального цикла гту
- •Регенеративный цикл гту
- •Регенеративный цикл гту с двухступенчатым сжатием и расширением рабочего тела
- •15.1. Задачи
- •15.2. Контрольные вопросы
- •16. Циклы паротурбинных установок
- •16.1. Базовый цикл пту – цикл Ренкина
- •Расчет простого обратимого цикла пту
- •Расчет необратимого цикла простой пту
- •Система кпд цикла пту
- •16.2. Цикл пту с вторичным перегревом пара
- •16.3. Регенеративный цикл пту
- •Выбор оптимальных давлений отборов пара турбины на регенеративные подогреватели пту
- •Особенности расчета регенеративных пту с подогревателями поверхностного типа
- •16.4. Теплофикационные циклы пту
- •Теплофикационные пту с отборами пара на тепловые потребители
- •16.5. Термодинамические особенности расчета циклов аэс на насыщенном водяном паре
- •16.6. Задачи
- •16.7. Контрольные вопросы
- •17. Циклы парогазовых установок
- •17.1. Цикл пгу с котлом-утилизатором
- •17.2. Циклы пгу со сжиганием топлива в паровом котле
- •Цикл пгу с низконапорным парогенератором
- •Цикл пгу с высоконапорным парогенератором
- •Полузависимая пгу
- •17.3. Задачи
- •17.4. Контрольные вопросы
- •18. Циклы холодильных установок и тепловых насосов
- •18.1. Цикл воздушной холодильной установки (вху)
- •Методика расчета вху
- •18.2. Цикл парокомпрессорной холодильной установки
- •Методика расчета цикла пкху
- •18.3. Парокомпрессорный цикл теплового насоса
- •Методика расчета цикла парокомпрессорного теплового насоса
- •18.4. Задачи
- •18.5. Контрольные вопросы
- •Заключение
- •Библиографический список
- •Приложения
- •Оглавление
- •Чухин Иван Михайлович
- •Редактор н.Б. Михалева
- •153003, Г. Иваново, ул. Рабфаковская, 34.
4.2. Контрольные вопросы
1.
Для какой термодинамической системы
записано уравнение
![]() ?
?
2. Какие виды энергетического взаимодействия тел рассматриваются в технической термодинамике?
3. В чем состоит сущность принципа эквивалентности теплоты и работы?
4. В каких случаях считается теплота величиной положительной?
5. В каких случаях считается работа изменения объема величиной положительной?
6. Какое принципиальное различие между понятиями «внутренняя тепловая энергия» и «теплота»?
7.
Какая принципиальная разница между
уравнениями f(р,
v,
Т)=0 и
![]() ?
?
8.
Для каких процессов целесообразно
использовать первый закон термодинамики
в виде уравнения
![]() ?
?
9. Сколько дифференциальных уравнений первого закона термодинамики можно записать ?
5. Политропные процессы изменения состояния идеальных газов
В переводе на русский язык слово «политропа» означает многообразие процессов, а в технической термодинамике политропными процессами называются закономерные газовые процессы. За величину, определяющую закономерность энергетического взаимодействия в газовом процессе, принимают отношение изменения внутренней энергии газа к количеству подведенной к нему теплоты:
 .
(5.1)
.
(5.1)
Если =const, то процесс будет политропным.
Для идеальных газов с постоянными изобарными и изохорными теплоемкостями закономерность процессов могут характеризовать следующие величины:
 или
или
![]() ,
(5.2)
,
(5.2)
 или
или
![]() , (5.3)
, (5.3)
где n – показатель политропы;
с – теплоемкость процесса.
Уравнения политропы, описывающие взаимосвязь параметров р,v, Т,v и р, Т, имеют вид
![]() ;
(5.4)
;
(5.4)
![]() ;
(5.5)
;
(5.5)
 .
(5.6)
.
(5.6)
Используя уравнения (5.4) (5.6), по двум состояниям газа в политропном процессе, можно определить показатель политропы, например, по уравнению (5.4):
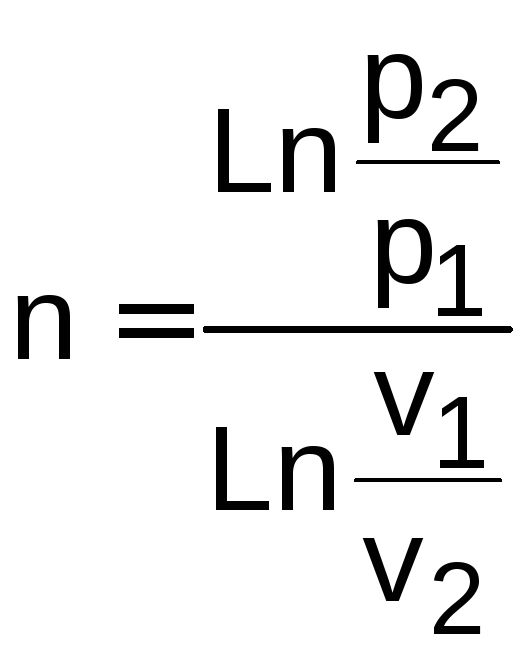 .
(5.7)
.
(5.7)
Расчет обратимых политропных процессов идеальных газов выполняется на основании уравнения первого закона термодинамики и формул (5.2) (5.6). Основные расчетные зависимости для политропных процессов идеальных газов приведены в табл. 5.1.
Таблица 5.1. Уравнения для расчета политропных процессов идеальных газов
|
Процессы |
n |
с |
a |
Уравнение |
q |
|
Ds |
Du, Dh |
|
р=const |
0 |
сp |
|
|
|
|
|
Du = cv(t2-t1), Dh = cp(t2-t1)
|
|
v=const |
±¥ |
cv |
1 |
|
|
0 |
| |
|
T=const |
1 |
±¥ |
0 |
|
|
|
| |
|
s=const (dq=0) |
к |
0 |
±¥ |
|
0 |
|
0 | |
|
Политропа n=const, a=const |
|
|
|
|
|
|
|
На рис. 5.1 и 5.2 показаны основные политропные процессы идеальных газов в p,v- и T,s- диаграммах, проходящих через общую точку А, что позволяет наглядно сопоставить изображение политроп с различными значениями показателя политропы n.
Все политропы в p,v- диаграмме с положительным показателем n>0 располагаются во II и IV квадрантах относительно точки А, а с показателем n<0 – в I и III квадрантах относительно точки А.
Политропы в T,s- диаграмме, проходящие через I и III квадранты, относительно точки А имеют положительную теплоемкость, причем изохора круче изобары, т.к. cp>cv. Самая крутая политропа – адиабата, для нее теплоемкость равна нулю. Самая пологая политропа – изотерма, для нее теплоемкость равна бесконечности.
Политропы, проходящие в T,s- диаграмме через II и IV квадранты, имеют отрицательную теплоемкость, для них 1<n<к. В таких процессах при подводе теплоты температура газа уменьшается, а при отводе теплоты от газа его температура увеличивается.
Используя
графическое изображение процесса,
проводят его качественный анализ.
Например, по изображению процесса АВ
(рис. 5.2) видно, что это процесс с
отрицательной теплоемкостью с<0, т.к.
dT
и ds
имеют противоположные знаки; теплота
процесса qАВ>0
,т.к. ds>0;
u<0
и h<0,
т.к. dT<0;
работа изменения объема >0,
т.к. при 1<n<к (с<0) и ТВ<ТА
из уравнения политропы
![]() следует, чтоvВ>vА.
следует, чтоvВ>vА.


