
- •Министерство образования и науки Российской Федерации
- •Научный редактор
- •Введение
- •1. Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.1. Задачи
- •1.2. Контрольные вопросы
- •2. Законы и уравнения состояния идеальных газов. Смеси идеальных газов
- •2.1. Задачи
- •2.2. Контрольные вопросы
- •3. Теплоемкости газов и газовых смесей
- •3.1. Задачи
- •3.2. Контрольные вопросы
- •4. Первый закон термодинамики для закрытой системы
- •4.1. Задачи
- •4.2. Контрольные вопросы
- •5. Политропные процессы изменения состояния идеальных газов
- •5.1. Задачи
- •5.2. Особенности расчета процессов идеальных газов при учете влияния температуры на их изобарную и изохорную теплоемкости
- •5.3. Задачи
- •5.4. Контрольные вопросы
- •6. Термодинамические свойства воды и водяного пара. Процессы водяного пара
- •6.1. Задачи
- •6.2. Контрольные вопросы
- •7. Влажный воздух
- •Основные характеристики влажного воздуха
- •Характеристики атмосферного влажного воздуха
- •Область влажного ненасыщенного воздуха h,d- диаграммы
- •Область перенасыщенного влажного воздуха h,d- диаграммы
- •Пример пользования h,d- диаграммой
- •7.1. Задачи
- •7.2. Контрольные вопросы
- •8. Второй закон термодинамики
- •8.1. Задачи
- •8.2. Контрольные вопросы
- •9. Первый закон термодинамики для потока. Работа изменения давления в потоке. Эксергия в потоке
- •Работа изменения давления в потоке для адиабатных процессов
- •Эксергия в потоке
- •9.1. Задачи
- •9.2. Контрольные вопросы
- •10. Истечение газа и пара через сопловые каналы
- •Особенности расчета процесса истечения через сопло реальных веществ
- •Необратимое истечение газов и паров через сопло
- •Процессы торможения. Параметры заторможенного потока
- •Методика расчета соплового канала при истечении через него газа или пара с начальной скоростью больше нуля
- •10.1. Задачи
- •10.2. Контрольные вопросы
- •11. Дросселирование газов, паров и жидкостей
- •11.1. Задачи
- •11.2. Контрольные вопросы
- •12. Процессы смешения газов и паров
- •Смешение в объёме
- •Смешение в потоке
- •Смешение при заполнении объёма
- •12.1. Задачи
- •12.2. Контрольные вопросы
- •13. Циклы двигателей внутреннего сгорания
- •Цикл двс с подводом теплоты к рабочему телу при постоянном объеме
- •Цикл двс с подводом теплоты к рабочему телу при постоянном давлении
- •Цикл двс со смешанным подводом теплоты к рабочему телу
- •13.1. Задачи
- •13.2. Контрольные вопросы
- •14. Циклы воздушных реактивных двигателей
- •Цикл прямоточного врд
- •Цикл турбокомпрессорного врд
- •14.1. Задачи
- •14.2. Контрольные вопросы
- •15. Циклы газотурбинных установок
- •Методика расчета тепловой экономичности обратимого цикла гту
- •Тепловая экономичность реального цикла гту
- •Регенеративный цикл гту
- •Регенеративный цикл гту с двухступенчатым сжатием и расширением рабочего тела
- •15.1. Задачи
- •15.2. Контрольные вопросы
- •16. Циклы паротурбинных установок
- •16.1. Базовый цикл пту – цикл Ренкина
- •Расчет простого обратимого цикла пту
- •Расчет необратимого цикла простой пту
- •Система кпд цикла пту
- •16.2. Цикл пту с вторичным перегревом пара
- •16.3. Регенеративный цикл пту
- •Выбор оптимальных давлений отборов пара турбины на регенеративные подогреватели пту
- •Особенности расчета регенеративных пту с подогревателями поверхностного типа
- •16.4. Теплофикационные циклы пту
- •Теплофикационные пту с отборами пара на тепловые потребители
- •16.5. Термодинамические особенности расчета циклов аэс на насыщенном водяном паре
- •16.6. Задачи
- •16.7. Контрольные вопросы
- •17. Циклы парогазовых установок
- •17.1. Цикл пгу с котлом-утилизатором
- •17.2. Циклы пгу со сжиганием топлива в паровом котле
- •Цикл пгу с низконапорным парогенератором
- •Цикл пгу с высоконапорным парогенератором
- •Полузависимая пгу
- •17.3. Задачи
- •17.4. Контрольные вопросы
- •18. Циклы холодильных установок и тепловых насосов
- •18.1. Цикл воздушной холодильной установки (вху)
- •Методика расчета вху
- •18.2. Цикл парокомпрессорной холодильной установки
- •Методика расчета цикла пкху
- •18.3. Парокомпрессорный цикл теплового насоса
- •Методика расчета цикла парокомпрессорного теплового насоса
- •18.4. Задачи
- •18.5. Контрольные вопросы
- •Заключение
- •Библиографический список
- •Приложения
- •Оглавление
- •Чухин Иван Михайлович
- •Редактор н.Б. Михалева
- •153003, Г. Иваново, ул. Рабфаковская, 34.
Смешение в потоке
Смешение в потоке – это слияние нескольких потоков веществ в общий поток (рис.12.2).
Д авление
вещества в месте смешения должно быть
ниже минимального или равно минимальному
давлению смешивающихся потоков, т.е. в
расчетах оно должно быть задано.
авление
вещества в месте смешения должно быть
ниже минимального или равно минимальному
давлению смешивающихся потоков, т.е. в
расчетах оно должно быть задано.
Массовые расходы (кг/с) смешивающихся потоков обозначаются как G1, G2,..., Gn., а Gсм=G1+G2+...+Gn – расход смеси.
Уравнение первого закона термодинамики для адиабатно смешивающихся потоков имеет вид
![]() (12.9)
(12.9)
или,
используя массовые доли компонентов
смеси
![]() ,
получим выражение (12.9) в виде
,
получим выражение (12.9) в виде
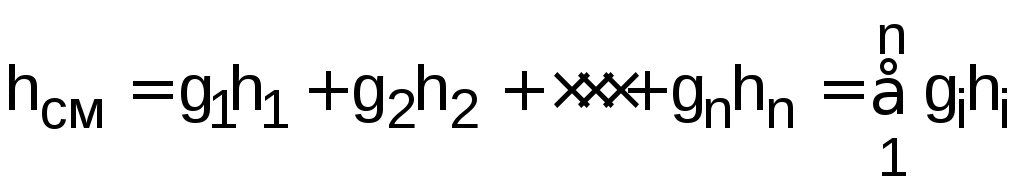 .
(12.10)
.
(12.10)
Давление рсм и энтальпия hсм определяют состояние смеси вещества и соответствующие ему параметры смеси: tсм, sсм и т.д..
Изменение энтропии системы за счет необратимости процесса смешения определяется как сумма изменений энтропий компонентов смеси газа:
 .
(12.11)
.
(12.11)
Выражение (12.11) можно представить для 1 кг смеси как
 .
(12.12)
.
(12.12)
Данным выражением удобно пользоваться при смешении потоков одного и того же вещества.
Для идеальных газов, приняв начало отсчета энтальпии от 0 оС и используя постоянные изобарные теплоемкости газов, уравнение (12.10) можно представить в виде
 .
(12.13)
.
(12.13)
Температура смеси идеальных газов, выраженная из уравнения (12.13), определяется как
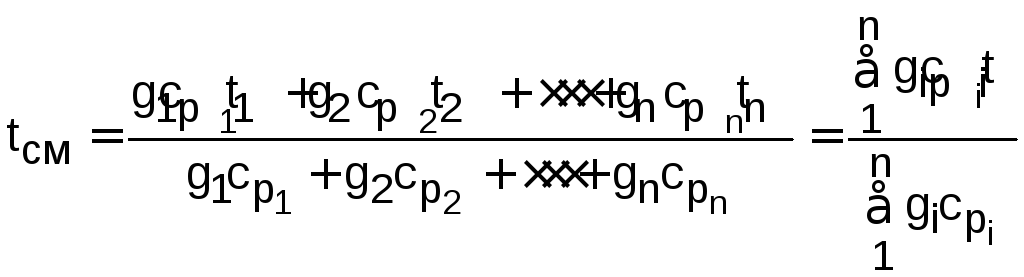 .
(12.14)
.
(12.14)
Выражение (12.14) справедливо и при подстановке в него всех температур по абсолютной шкале Кельвина.
Необратимость процесса смешения в потоке оценивается по увеличению энтропии системы аналогично смешению в объёме по формулам (12.8) и (12.11).
Смешение при заполнении объёма
Такой случай смешения в технике наиболее типичен при заполнении баллона газом из магистрального газопровода с постоянным давлением (рис. 12.3).
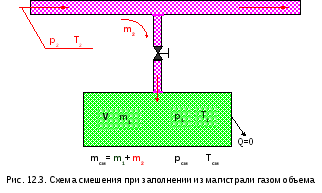
Пусть в баллоне до смешения находится газ массой m1 и параметрами р1, T1. При открытии вентиля из магистрали в баллон поступает другой газ массой m2 с параметрами р2, T2. Естественно, должно выполняться условие р2>р1. При закрытии вентиля устанавливаются новые параметры газа в баллоне: рсм и Tсм.
Уравнение такого смешения при адиабатном заполнении объема газом будет иметь вид
![]() (12.15)
(12.15)
или то же выражение для удельной внутренней энергии смеси газов:
![]() ,
(12.16)
,
(12.16)
где g1 и g2 – массовые доли компонентов смеси.
Необходимо обратить внимание на то, что в этих выражениях энтальпия относится к потоку газа, поступающего в баллон, т.к. индексация параметров газа в задачах такого типа может отличаться от данного примера.
Используя vсм и uсм , можно определить все остальные параметры смеси газа.
Определение параметров в этом процессе смешения для идеальных газов наиболее просто выполняется если принять начало отсчёта внутренней энергии и энтальпии при абсолютном нуле – 0 K, т.к. их численные значения при этой температуре будут одинаковы и равны нулю uосм=uо1=hо2=0, а выражение (12.16) при замене в нем внутренних энергий и энтальпий через теплоемкости и абсолютные температуры примет вид
![]() .
(12.17)
.
(12.17)
В результате получаем выражение для определения абсолютной температуры смеси идеальных газов
 .
(12.18)
.
(12.18)
Выражения (12.17) и (12.18) справедливы только при подстановке в него абсолютных температур, для температур в градусах по Цельсию оно непригодно.
Остальные расчетные выражения этого процесса смешения по определению давления смеси и увеличения энтропии системы аналогичны процессу смешения в объеме.
