
Журнал неврологии и психиатрии / 2010 / NEV_2010_04_041
.pdf
Сравнительная эффективность карбамазепина, препаратов вальпроевой кислоты и топирамата при височной медиальной эпилепсии у детей
К.м.н. С.Р. БОЛДЫРЕВА1, к.м.н. А.Ю. ЕРМАКОВ2
Efficacy of carbamazepine, valproate and topiramate in the treatment of medial temporal epilepsy in children
S.R. BOLDYREVA, A.Yu. ERMAKOV
1Детская городская больница №1, Санкт-Петербург; 2Московский НИИ педиатрии и детской хирургии
Для оценки эффективности вальпроатов (VPA), карбамазепина (CBZ) и топирамата (TPM) были отобраны 205 пациентов с дебютом заболевания в возрасте до 16 лет с диагнозом медиальной височной эпилепсии. Срок наблюдения от момента последнего изменения терапии составил от 2 до 5 лет. Группы пациентов, получавших CBZ, VPA и TPM, достоверно не отличались по распространенности прогностически неблагоприятных факторов и режиму дозирования препаратов, что позволило проводить прямое сравнение их эффективности. Было установлено, что терапевтическая эффективность VPA при медиальной височной эпилепсии у детей выше, чем CBZ (79% против 61%, p<0,05) и TPM (79% против 53%, p<0,001). При применении CBZ чаще отмечалась аггравация эпилептического процесса по сравнению с применением VPA (10% против 1%, p<0,001). При наличии клинико-энцефалографических маркеров значимого органического поражения головного мозга и при дебюте заболевания до 1 года CBZ был неэффективен, несколько выше была эффективность при применении TPM (20%, p<0,05) и максимальна при лечении VPA (50%, p<0,001). При фокальных корковых дисплазиях и исходе перивентрикулярной лейкомаляции эффективность CBZ ниже, чем эффективность VPA (0% для CBZ против 89% для VPA — p<0,01 и 40% для CBZ против 77% для VPA — p<0,05 соответственно) и TPM (0% для CBZ против 100% для TPM — p<0,01 и 40% для CBZ против 100% для TPM — p<0,01 соответственно). При отсутствии нейрорадиологических изменений наиболее эффективно применение VPA (90% против 53% для CBZ, p<0,001и67%дляTPM,p<0,05).ЭффективностьCBZвзависимостиотколичестваранеепримененныхантиэпилептических препаратов (АЭП) снижается (в качестве первого АЭП 52% против 17% в качестве второго АЭП, p<0,01), в меньшей степени это наблюдается при использовании TPM (80% и 46% соответственно, p<0,05), и отсутствует при лечении VPA (77% и 75%, p>0,05 соответственно). Нежелательные эффекты достоверно чаще встречаются при лечении CBZ, чем при использовании VPA (19% против 5%, p<0,001) и TPM (19% против 9%, p<0,05).
Ключевые слова: эпилепсия у детей, височная медиальная эпилепсия, карбамазепин, вальпроаты, топирамат, побочные явления.
For a retrospective observational investigation based on real clinical practice of relative efficacy of valpoic acid (VPA), carbamazepine (CBZ) and topiramate (TPM) we have selected 205 patient with age of seizure onset before 16 years with a undoubted diagnosis of medial temporal lobe epilepsy, who had received treatment according to ILAE recommendations, and observation time since the last treatment change was from 2 to 5 years. The groups of patient receiving CBZ, VPA и TPM did not differ significantly in presenting unfavorable prognostic factors and dose regimes that allowed to conduct direct comparison of efficacy of the investigated drugs. Efficacy of VPA in children with medial temporal lobe epilepsy was higher compared with CBZ (79% vs 61%; p<0,05) and TPM (79% vs 53%; p<0.001). CBZ caused seizure aggravation more frequently than VPA (10% vs 1%; p<0,001). In case of presence of clinico-electroencephalografic signs of significant organic brain damage and in patient with seizure onset before age of 1 year CBZ was not effective while TPM showed efficacy of 20%, (p<0,05) and VPA was the most effective drug in this case (50%; p<0,001). In case of focal cortical dysphasia or the states after periventricular leucomalacia the efficacy of CBZ was lower than VPA (0% for CBZ vs 89% for VPA — p<0,01 and 40% for CBZ vs 77% for VPA — p<0,05, respectively) and TPM (0% for CBZ vs 100% for TPM — p<0,01 and 40% for CBZ vs 100% for TPM — p<0,01, respectively). In MRI-negative cases VPA was most effective (90% vs 53% for CBZ; p<0,001 and 67% for TPM; p<0,05). Efficacy CBZ reduces proportionally the number of previously used antiepileptic drugs (AEDs) (52% as a first AED vs 17% as a second AED; p<0,01), this tendency is noted also for TPM but in less extend (80% vs 46%, respectively p<0,05), but not for VPA (77% vs 75%; p>0,05, respectively). Adverse effects were more frequent during treatment with CBZ, than VPA (19% vs 5%; p<0,001) and TPM (19% vs 9%; p<0,05).
Key words: Medial temporal lobe epilepsy, children, carbamazepine, topiramate, valpoic acid.
В последние годы достигнуты значительные успехи в медикаментозном лечении эпилепсии [44]. Появились новые модификации классических противоэпилептических препаратов (ПЭП), обладающие меньшей токсичностью и большей эффективностью. Создание ретардированных
форм позволяет сократить кратность приема препарата, что делает его использование более удобным и повышает качество жизни пациентов [5]. Проведенные исследования новых ПЭП позволили определить их неодинаковую эффективность в различных клинических ситуациях.
© С.Р. Болдырева, А.Ю. Ермаков, 2010 |
1е-mail: spb-epi@mail.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:4:41 |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2010 |
41 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
До 1994 г. при парциальных приступах в основном использовалось всего 5 препаратов: фенобарбитал (PB), примидон (PRM), фенитоин (PHT), карбамазепин (CBZ), препараты вальпроевой кислоты (VPA) [21, 22, 28]. В сравнительном исследовании [6] у больных с парциальными формами эпилепсии в условиях, приближенных к реальной клинической практике, эффективность этих препаратов оказалась одинаковой, но переносимость CBZ и VPA, при применении которых осложнения составили по 4% против 9% по отношению PHT и 60% — PB, оказалась лучше. В детской популяции данные о большей эффективности CBZ по сравнению с VPA не нашли подтверждения [15, 24, 46]. K. Van Rijckevorsel [46], подтверждая равную активность VPA, CBZ, PHT и PB при парциальных эпилепсиях, считает, что у детей предпочтительнее применение VPA при наличии сомнений в точной идентификации синдрома из-за потенциального риска аггравации приступов. Таким образом, CBZ и VPA могут и сегодня считаться препаратами первого выбора у детей с парциальными приступами. PB и PHT, напротив, рекомендуется использовать в последнюю очередь из-за их побочных эффектов [22].
В последние два десятилетия в клиническую практику введены сразу 12 новых ПЭП: фелбамат, габапентин, ламотриджин, топирамат, тиагабин, вигабатрин, окскарбазепин, леветирацетам, зонизамид, прегабалин, руфинамид, лакозамид, что, с одной стороны, дает шанс купирования приступов у ранее резистентных больных, с другой
— значительно удлиняет процесс подбора оптимальной терапии. В связи с этим необходимо определить особенности каждого препарата для оптимального выбора в каждой конкретной ситуации [27]. Большой выбор препаратов диктует необходимость индивидуального подхода к выбору ПЭП с учетом преморбидного состояния пациента [11].
Показана высокая эффективность топирамата (TPM) в отношении парциальных эпилепсий как в качестве дополнительной терапии у резистентных больных, так и в монотерапии [3, 7, 37, 43]. В открытом исследовании [42] показана большая эффективность TPM в сравнении с «эталонным» препаратом — CBZ. Однако при использовании данного препарата отмечается достаточно высокий риск нежелательных эффектов [7, 37, 43], в том числе негативного влияния на психические функции, особенно у пациентов с изменениями в височной доле [9, 38]. Кроме того, следует отметить риск аггравации приступов [6] под действием препарата и относительно высокую частоту развития рецидива приступов после периода ремиссии на фоне неизменной терапии [13]. Ламотриджин уступает по эффективности CBZ [40] и TPM [35].
Большинство экспертов рекомендуют включать в стандарты лечения парциальных эпилепсий у детей CBZ, VPA, TPM и OXC [16, 19, 21, 22, 28, 29, 39] (последний на российском рынке появился недавно).
Появление новых ПЭП дает возможность использовать практически неограниченное количество комбинаций [2]. Для рационализации процесса подбора оптимальной терапии в Глазго было предпринято широкое длительное проспективное исследование, в которое были включены пациенты с дебютом эпилепсии в детском и подростковом возрасте. Было показано, что у 47% больных приступы были купированы на первом препарате, у 13% — на втором и только 4% — на третьем или на комби-
нации 2 препаратов [33]. В связи с этим очень важен выбор первого препарата. Если в отношении отдельных эпилептических синдромов (ювенильная миоклоническая эпилепсия, инфантильные спазмы при туберозном склерозе) оптимальные препараты известны [10], то в отношении симптоматических парциальных эпилепсий данных о сравнительной эффективности отдельных ПЭП в зависимости от характеристик эпилептического процесса недостаточно.
Цель настоящего исследования состояла в определении эффективности CBZ, VPA и TPM при височной медиальной эпилепсии у детей в зависимости от особенностей эпилептического процесса.
Материал и методы
Для данного исследования были отобраны 205 пациентов (123 мальчика и 82 девочки).
В исследование были включены пациенты, диагноз медиальной височной эпилепсии у которых не вызывал сомнения и лечение осуществлялось согласно рекомендациям Международной антиэпилептической лиги (ILAE) [14]. Диагноз устанавливался на основании клинических данных, ЭЭГ и МРТ. При оценке данных ЭЭГ использовались унифицированные понятия и критерии в соответствии с классификацией Международной федерации электроэнцефалографических обществ и клинической физиологии (IFSECN) [12, 41].
Терапия начиналась с CBZ, если не было противопоказаний для его применения, в качестве альтернативной монотерапии использовались VPA или, реже, TPM. При неэффективности первого препарата производилась его замена или перевод на терапию двумя препаратами. Срок наблюдения от момента последнего изменения терапии до момента оценки эффекта терапии составил в среднем 3,5±0,1 года: от 2 до 3 лет — 28%, от 3 до 4 лет — 33%, более 4 лет — 39% случаев. При полной отмене терапии после длительной ремиссии припадков срок наблюдения для оценки результата составил не менее 3 лет [36].
CBZ был назначен 125 пациентам, VPA — 128, ТPM
— 35. Всего монотерапию получали 184 (91%) пациента, терапию двумя препаратами — 21 (9%). Эти пациенты достоверно не различались по клиническим характеристикам — вид и частота приступов, возраст больных к моменту дебюта заболевания, длительность заболевания до начала лечения, наличие фебрильных судорог в анамнезе, неврологических очаговых симптомов, аффективных расстройств и снижения познавательных способностей. Также не выявлено различий по электроэнцефалографическим (за исключением феномена вторичной билатеральной синхронизации, который является противопоказанием для назначения CBZ) и нейрорадиологическим характеристикам, а также режиму дозирования препаратов, что позволило проводить прямое сравнение их эффективности (табл. 1). Различалась лишь очередность назначения препарата: в подавляющем большинстве случаев CBZ назначался в качестве инициальной терапии (94%), VPA значительно реже – в 61% случаев. TPM чаще, чем CBZ и VPA, применялся при неэффективности других препаратов (см. табл. 1).
Заметим, что в лечебную группу вошли лишь потенциально курабельные пациенты. На момент проведения исследования у 88% пациентов отмечалось отсутствие
42 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2010 |

ЛЕЧЕНИЕ ЭПИЛЕПСИИ У ДЕТЕЙ
Таблица 1. Характеристика групп пациентов, леченных различными препаратами
Признак |
CBZ (n=125) |
VPA (n=128) |
TPM (n=35) |
Возраст больных к моменту дебюта заболевания, годы |
11±4,7 |
9,9±5,1 |
9,5±5,5 |
Число пациентов с дебютом заболевания, % |
|
|
|
до 1 года |
5 |
9 |
14 |
1—3 года |
6 |
5 |
5 |
4—6 лет |
10 |
14 |
14 |
7—10 лет |
21 |
19 |
16 |
11—14 лет |
32 |
31 |
27 |
15—18 лет |
26 |
22 |
24 |
Частота приступов в месяц |
71,5±18,9 |
108,9±23,7 |
188,3±50,5 |
Частота очаговых симптомов поражения ЦНС, % |
16 |
16 |
17 |
Частота интеллектуально-мнестического снижения, % |
19 |
20 |
22 |
Частота аффективных расстройств, % |
14 |
19 |
25 |
Частота наличия изменений МРТ, % |
48 |
41 |
47 |
Частота криптогенной эпилепсии, % |
50 |
56 |
41 |
Частота наличия изменений ЭЭГ, % |
|
|
|
диффузные изменения фоновой активности |
30 |
31 |
42 |
длительного регионального замедления |
52 |
44 |
58 |
эпилептиформной активности |
91 |
95 |
94 |
вторичной билатеральной синхронизации |
17 |
63*** |
36 |
Число пациентов, получавших следующие дозы препарата, % |
|
|
|
низкие |
44 |
36 |
53 |
средние |
42 |
48 |
36 |
высокие |
14 |
17 |
11 |
Число пациентов, ранее не получавших ПЭП, % |
94 |
61*** |
14*** |
Число пациентов, ранее применявших ПЭП, % случаев |
|
|
|
1 ПЭП |
6 |
36*** |
44*** |
2 ПЭП |
0 |
3 |
36*** |
3 ПЭП |
0 |
0 |
6 |
Примечание. Низкие дозы: CBZ — менее 12 мг/кг/сут, VPA — менее 20 мг/кг/сут, ТРМ — менее 2 мг/кг/сут; средние дозы: CBZ — 12—30 мг/кг/сут, VPA — 20—40 мг/кг/сут, ТРМ — 3—10 мг/кг/сут; высокие дозы: CBZ — более 30 мг/кг/сут, VPA — более 40 мг/кг/сут, ТРМ — более 10 мг/кг/сут. *** — p<0,001.
Таблица 2. Распределение больных (%) в соответствии с результатами терапии
Результаты терапии |
CBZ (n=125) |
VPA (n=128) |
TPM (n=35) |
Полный контроль над приступами (ремиссия) |
61 |
79 |
53 |
в том числе с последующей успешной отменой ПЭП |
27 |
28 |
0 |
Снижение числа приступов >75% |
7 |
11 |
14 |
Снижение числа приступов на 50—75% |
10 |
5 |
0 |
Рецидив приступов |
10 |
2 |
22 |
Без эффекта |
2 |
2 |
8 |
Ухудшение |
10 |
1 |
3 |
припадков (57% — медикаментозная ремиссия, 31% — |
ный контроль над припадками»). Сокращение числа при- |
на фоне отмены препарата в течение не менее 3 лет), у 8% |
ступов на 75% с уменьшением их глубины и длительности |
больных было достигнуто значительное улучшение (со- |
— определяем как «значительное улучшение»; сокраще- |
кращение числа приступов более чем на 75%, уменьше- |
ние числа приступов на 50—75% — «умеренное улучше- |
ние глубины и длительности приступов), у 1% — умерен- |
ние». |
ное улучшение (снижение частоты приступов на 50— |
Пациенты систематически наблюдались эпилептоло- |
75%), и в 3% случаев после периода контроля над при- |
гом: оценивались клиническое состояние, ЭЭГ для опре- |
падками в течение 6—14 мес на фоне неизменной тера- |
деления адекватности лечения. Кроме того, проводилось |
пии возник рецидив в виде учащения припадков до ис- |
постоянное обследование для выявления возможных не- |
ходного уровня. |
желательных явлений в зависимости от профиля безопас- |
Специально подчеркнем, что в данном исследовании |
ности препарата. |
под эффективностью препарата подразумевалось дости- |
Для статистической обработки применяли парамет- |
жение медикаментозной ремиссии длительностью не ме- |
рический метод оценки достоверности разностей между |
нее 3 лет (в этом случае используется определение «пол- |
долями. |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2010 |
43 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
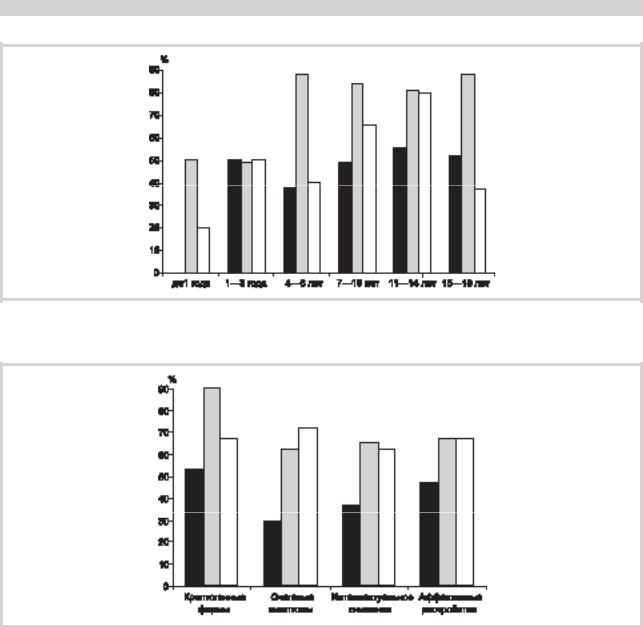
Рис. 1. Доля пациентов, достигших ремиссии, при лечении CBZ, VPA и TPM в зависимости от возраста больных к периоду начала заболевания.
Здесь и на рис. 2 и 3: темные столбцы — CBZ, cветлые — TPM, серые — VPA.
Рис. 2. Доля пациентов, достигших ремиссии, при лечении CBZ, VPA и TPM в зависимости от наличия очаговых симптомов поражения ЦНС, интеллектуально-мнестического снижения и аффективных расстройств.
Результаты
При применении VPA достоверно чаще достигалась ремиссия, чем при применении CBZ (79% против 61%, p<0,05) и TPM (79% против 53%, p<0,001). Кроме того, при применении CBZ достоверно чаще отмечалась аггравация эпилептического процесса по сравнению с применением VPA (10% против 1%, p<0,001), несмотря на предварительное выделение «группы риска» (табл. 2).
Различия эффективности исследуемых препаратов в зависимости от возраста начала заболевания наиболее ярко проявляются в группе детей, заболевших в возрасте до 1 года (23 пациента), где CBZ не позволил достичь контроля над приступами ни в одном случае, при применении TPM ремиссия достигнута в 20% случаев, а при лечении VPA — в 50% (p<0,001 и p<0,05). Число детей, достигших ремиссии при лечении VPA, было достоверно больше, чем при лечении CBZ, у детей с дебютом заболевания
в возрасте старше 4 лет (p<0,001 для всех возрастных групп) (рис. 1).
При криптогенных формах эпилепсии VPA оказались наиболее эффективными ПЭП: доля пациентов с контролем над приступами достигла 90% против 53% при лечении CBZ (p<0,001) и 67% при лечении TPM (p>0,05). Эффективность VPA также оказалась достоверно выше по сравнению с CBZ при наличии очаговых симптомов поражения ЦНС (62% против 29%; p<0,01), интеллектуальномнестическом снижении (65% против 37%; p<0,05) и несколько выше при аффективных расстройствах — 67% против 47% (p>0,05). При клинических признаках органического поражения головного мозга при применении TPM были получены показатели, сопоставимые с терапией VPA, отличия от пациентов, получавших CBZ, не были статистически значимыми (рис. 2).
При лечении VPA по сравнению с CBZ достоверно чаще удавалось достичь контроля над приступами при на-
44 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2010 |
ЛЕЧЕНИЕ ЭПИЛЕПСИИ У ДЕТЕЙ
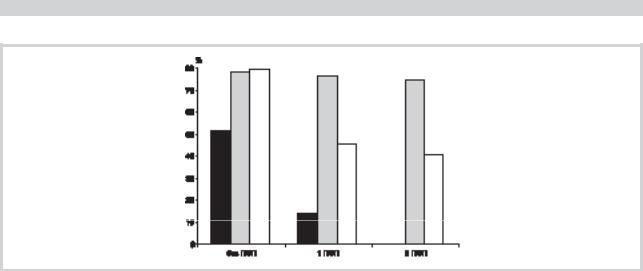
Рис. 3. Доля пациентов, достигших ремиссии, при лечении CBZ, VPA и TPM в зависимости от количества ранее применямых ПЭП.
личии диффузных изменений фоновой активности на ЭЭГ (70%), длительного регионального замедления (74% против 52%) и эпилептиформной активности (84% против 66%). Лечение TPM также достоверно чаще вызывало полный контроль над приступами, чем лечение CBZ, при наличии диффузных изменений фоновой активности (67% против 37%). При других феноменах на ЭЭГ результаты терапии TPM статистически значимо не отличались от CBZ.
Доля пациентов в ремиссии с наличием патологических изменений на МРТ была практически одинаковой при применении CBZ, VPA и TPM (67, 75 и 76% соответственно). Однако VPA и TPM оказались достоверно более эффективными при фокальных корковых дисплазиях, тогда как при лечении CBZ ни у одного пациента достичь контроля над приступами не удалось. При асимметричном расширении боковых желудочков (исход перивентрикулярной лейкомаляции) VPA и TPM также оказались более эффективными по сравнению с CBZ — 77% против 40% (p<0,05) и 100% против 40% (p<0,05 и p<0,001 соответственно).
При инициальной терапии VPA полный контроль над приступами достигнут в достоверно большем числе случаев, чем при инициальной терапии CBZ (79% против 52%; p<0,05). Результаты инициальной терапии TPM достоверно не отличались от CBZ. При назначении CBZ после предшествующей безуспешной терапии другим ПЭП доля пациентов, достигших ремиссии, снижается до 17% (p<0,01). Доля пациентов с полным контролем над припадками при назначении TPM при неэффективности других препаратов также снижается с 80 до 46% (p>0,05). Эффективность VPA не зависит от очереди их применения и превышает таковую у CBZ. В качестве препарата второго выбора TPM оказался более эффективным в достижении ремиссии, чем CBZ (46% против 17%; p<0,05) (рис. 3).
Несмотря на тщательный предварительный отбор пациентов, нежелательные эффекты терапии CBZ отмечены в 24 (19%) случаях, что у 20 больных потребовало отмены препарата. Наиболее часто отмечались нейротоксические эффекты: сонливость, снижение памяти, внимания, работоспособности отмечены у 11 (7%) пациентов, аггравация эпилептического процесса с появлением феномена вторичной билатеральной синхронизации — у 13 (10%), миоклонус — у 4 (3%), у 2 развился феномен насильственной нормализации ЭЭГ. Аллергические реакции появились у
6 (5%) пациентов, несмотря на то что всем детям с предрасположенностью к аллергическим проявлениям предварительно проводилась реакция дегрануляции тучных клеток с ПЭП. Другие соматические осложнения (гепатит, лейкопения, атриовентрикулярная блокада) встречались редко — по 1 случаю. Все нежелательные эффекты возникли на относительно низких дозах препарата (до 15 мг/кг/сут) при монотерапии CBZ. На возраст от 11 до 17 лет приходится 75% всех случаев нежелательных эффектов CBZ, от 7 до 10 лет — 16%, от 4 до 6 лет — 11 и 8% — на возраст до 1 года.
Нежелательные эффекты VPA отмечены у 7 (5%) пациентов. Наиболее частым и серьезным осложнением являлась тромбоцитопения — 3 (4%) случая. Транзиторный нейротоксический эффект отмечен у 2 пациентов: у одного отмечалась аггравация припадков, у другого — транзиторное снижение работоспособности, купировавшееся при снижении дозы препарата. Избыточная прибавка массы тела, неподдающаяся диетической коррекции, и выпадение волос резистентное к терапии фолиевой кислотой и местному лечению, отмечались редко (по 1 случаю) и не требовали отмены препарата. Все нежелательные эффекты наблюдались при средних и низких дозах препарата (до 25 мг/кг/сут) при монотерапии VPA. Нежелательные явления были представлены во всех возрастных группах в равной степени.
Нежелательные эффекты TPM отмечены у 3 (9%) пациентов на фоне применения предельно низких доз препарата в режиме монотерапии феномен насильственной нормализации ЭЭГ, энурез и экзацербация эпилептического процесса — по 1 случаю. Один больной был старше 15 лет и один — 5 лет.
В целом нежелательные эффекты достоверно чаще наблюдались при лечении CBZ, чем при применении VPA (19% против 5%; p<0,001) и TPM (19% против 9%; p<0,05).
Обсуждение
Как говорилось выше, для оценки эффективности терапии в группу обследованных вошли потенциально курабельные пациенты. Это обстоятельство не должно было существенно исказить результаты сравнения эффективности изучавшихся ПЭП, так как исключенные пациенты
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2010 |
45 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 3. Известные механизмы действия ПЭП [1]
Препарат |
Механизм действия |
CBZ |
Na+ |
VPA |
Na+, [ Ca2+ ( T – type)], |
|
ГАМК |
ТPM |
Na+, ГАМК , глутамат |
были резистентны ко всем используемым препаратам. В то же время такой отбор пациентов позволял оценить эффективность терапии ПЭП с учетом риска рецидива приступов после периода ремиссии в течение нескольких месяцев, что наблюдается нередко [6, 47].
Вданном исследовании группы пациентов, получавших CBZ, VPA и TPM, не отличались достоверно по возрасту. Различий в частоте наличия очаговых симптомов в неврологическом статусе, интеллектуально-мнестичес- кого снижения, аффективных расстройств, фебрильных судорог в анамнезе и криптогенных форм эпилепсии в подгруппах также не было. Это позволило проводить прямое сравнение эффективности применяемых препаратов. Режим дозирования данных препаратов статистически значимо не отличался — большинство пациентов получали препараты в низких и средних дозах.
Висследованной группе детей с височной медиальной эпилепсией при применении VPA достоверно чаще (79%) достигалась ремиссия, чем при применении CBZ (61%) и TPM (53%). Вероятно, это обусловлено высокой частотой (40%) появления феномена вторичной билатеральной синхронизации в данной когорте. Кроме того, VPA часто применялись у пациентов, резистентных к CBZ. Эффективность VPA у пациентов с парциальными эпилепсиями была также показана в других исследованиях [4], в том числе и у резистентных к CBZ [15].
Воткрытом исследовании [42] показана большая эффективность TPM в сравнении с «эталонным» CBZ. Статистически значимого различия между долей пациентов, достигших ремиссии при лечении CBZ и TPM, по нашим данным, не получено (61 и 53% соответственно). Кроме того, в нашем исследовании в большинстве случаев TPM применялся при неэффективности и/или непереносимости других ПЭП. Этим же можно было бы объяснить и несколько более высокий процент рецидивов после периода контроля над припадками при применении TPM по сравнению с CBZ и VPA. Однако это согласуется с данными литературы [6, 13] о значительной частоте рецидива приступов на фоне неизменной терапии TPM.
При применении CBZ достоверно чаще отмечалась аггравация эпилептического процесса по сравнению с VPA (10% против 1%; p<0,001), несмотря на предварительное выделение «группы риска», что соответствует данным литературы [25].
Различия эффективности наиболее часто используемых препаратов в зависимости от возраста начала заболевания наиболее ярко проявляются в группе детей, забо-
левших в возрасте до 1 года, в которой CBZ не позволил достичь контроля над приступами ни в одном случае, TPM позволил купировать приступы у каждого пятого ребенка, а VPA — у каждого второго. Вероятно, это обусловлено особенностями эпилептогенеза при раннем формировании эпилепсии и особенностями морфологических изменений [17, 26, 31, 34, 45, 48], которые обусловливают большую эффективность препаратов с множественными механизмами действия по сравнению с блокатором натриевых каналов [1] (табл. 3).
При инициальной терапии VPA полный контроль над приступами достигнут в достоверно большем числе случаев (79%), чем при инициальной терапии CBZ (52%). Результаты инициальной терапии TPM достоверно не отличались от CBZ.
При назначении CBZ после предшествующей безуспешной терапии другим ПЭП доля пациентов, достигших ремиссии, снижается до 17%, что согласуется с данными P. Kwan, M. Brodie [33] о прогрессивном снижении эффективности препарата в зависимости от очереди применения. Эта закономерность в меньшей степени отмечается при применении TPM; его эффективность в качестве препарата второго выбора оказалась выше, чем у CBZ (46% против 17%). Эффективность же VPA не зависит от очереди их применения и превышает эффект CBZ. Очевидно, это обусловлено множественными механизмами действия VPA и в меньшей степени TPM [1].
Нежелательные эффекты достоверно чаще наблюдались при лечении CBZ (19%), чем при применении VPA (5%) и TPM (9%). В литературе представлены аналогичные данные о частоте нежелательных эффектов CBZ [18, 23, 40], TPM [7, 30, 32, 37] и VPA [8, 20, 24, 39].
Полученные результаты позволяют сделать следующие выводы: 1. Терапевтическая эффективность препаратов вальпроевой кислоты при медиальной височной эпилепсии у детей выше, чем карбамазепина и топирамата. 2. При наличии клинико-энцефалографических маркеров органического поражения головного мозга и при начале заболевания в возрасте до 1 года карбамазепин неэффективен, несколько выше вероятность достижения ремиссии в этих случаях при применении топирамата (20%) и максимальна при лечении препаратами вальпроевой кислоты (50%). 3. При фокальных корковых дисплазиях и последствиях перивентрикулярной лейкомаляции эффективность карбамазепина ниже, чем препаратов вальпроевой кислоты и топирамата. 4. При отсутствии нейрорадиологических изменений наиболее эффективно (90%) применение препаратов вальпроевой кислоты. 5. Эффективность карбамазепина снижается по мере увеличения количества ранее примененных ПЭП; в меньшей степени это наблюдается при использовании топирамата, и такая зависимость отсутствует при лечении препаратами вальпроевой кислоты. 6. Нежелательные эффекты достоверно чаще встречаются при лечении карбамазепином, чем при использовании препаратов вальпроевой кислоты и топирамата.
ЛИТЕРАТУРА
1. Аванцини Д. Перспективы эпилептологии. В кн.: Международная 2. |
Броди М. Течение и рациональная терапия эпилепсии. В кн.: Между- |
конференция «Эпилепсия — медико-социальные аспекты, диагно- |
народная конференция «Эпилепсия – медико-социальные аспекты, |
стика и лечение». М 2004;16—28. |
диагностика и лечение». М 2004;62—88. |
46 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2010 |

ЛЕЧЕНИЕ ЭПИЛЕПСИИ У ДЕТЕЙ
3.Калинин В.В., Железнова Е.В., Соколова Л.В. и др. Монотерапия пар28. French J.A., Kanner A.M., Bautista J. et al. Therapeutics and Technology
циальных форм эпилепсии топамаксом. Журн невролол и психат 2004;104:7:35—38.
4.Карлов В.А., Власов П.Н., Хабибова А.О. Депакин 300 и депакин-хроно в терапии эпилепсии. Журн неврол и психиат 1999;99:10:20—25.
5.Карлов В.А., Бондарева И.Б., Андреева О.В. Оптимизация дозирования препаратов финлепсин и финлепсин-ретард у больных парциальной эпилепсией на основе популяционного моделирования и лекарственного мониторинга. Журн неврол и психиат 2002;102:6:15—20.
6.Мухин К.Ю., Петрухин А.С., Миронов М.Б. Клиническая эффективность и переносимость топамакса при комбинированной терапии эпилепсии. Журн неврол и психиат 2003;103:3:28—33.
7.Мухин К.Ю., Глухова Л.Ю., Петрухин А.С. и др. Топамакс при монотерапии эпилепсии. Журн неврол и психиат 2004;104:8:35—40.
8.Пылаева О.А., Петрухин А.С., Воронкова К.В. Эффективность и безопасность антиэпилептической терапии у детей (сравнительная оценка препаратов вальпроевой кислоты и барбитуратов). Журн неврол и психиат 2004;104:8:61—65.
9.Aldenkamp A.P., Baker G., Mulder O.G. et al. A multicenter, randomized clinical study to evaluate the effect on cognitive function of topiramate compared with valproate as add-on therapy to carbamazepine in patients with partial-onset seizures. Epilepsia 2000;41:9:1167—1178.
10.Appleton R.E., Peters A.C., Mumford J.P., Shaw D.E. Randomized, placebocontrolled study of vigabatrine as first-line treatment of infantile spasms. Epilepsia 1999;40:1627—1633.
11.Asconape J.J. Some common issues in the use of antiepileptic drugs. Semin Neurol 2002;22:1:27—39.
12.Binnie C.B., van Emde B.W., Prior P.F. et al. EEG phenomenology. In: Clinical Neurophysiology, v. 2. EEG, Pediatric Neurophysiology, Special Techniques and Applications. Eds. C. Binnie et al. Amsterdam 2003;104—215.
13.Bootsma H.P., Coolen F., Aldenkamp A.P. et al. Topiramate in clinical practice: long-term experience in patients with refractory epilepsy referred to a tertiary epilepsy center. Epilepsy Behav 2004;5:3:380—387.
14.Brodie M.J., Shorvon S.D., Canger R. et al. Commission on European Affairs: appropriate standards of epilepsy care across Europe. ILAE. Epilepsia 1997;38:11:1245—1250.
15.Brodie M.J., Mumford J.P. Double-blind substitution of vigabatrin and valproate in carbamazepine-resistant partial epilepsy. 012 Study group. Epilep Res 1999;34:2—3:199—205.
16.Brodie M.J., Schachter S.C. Fast facts: Epilepsy. 2nd edition. Oxford 2001.
17.Cepeda C., André V.M., Levine M.S. et al. Epileptogenesis in pediatric cortical dysplasia: the dysmature cerebral developmental hypothesis. Epilep Behav 2006;9:2:219—235.
18.Chadwick D.W., Anhut H., Greiner M.J. A double-blind trial of gabapentin monotherapy for newly diagnosed partial seizures. International Gabapentin Monotherapy Study Group. Neurology 1998;51:1282—1288.
19.Chockrell O.C., Shorvon S. Epilepsy: current concepts. London 1996;25— 28.
20.Christe W., Kramer G., Vigonius U. A double-blind controlled clinical trial: oxcabazepine versus sodium valpoate in adults with newly diagnosed epilepsy. Epilep Res 1997;27:451—460.
21.Connock M., Frew E., Evans B.W. et al. The clinical effectiveness of newer drugs for children with epilepsy. A systematic review. Health Technol Ass 2006;10:7:1—1149.
22.Coppola G. Treatment of partial seizures in childhood. CNS Drugs 2004;18:3:133—156.
23.Dam M., Ekberg K., Loining Y. A double-blind study comparing oxcabazepine and carbamazepine in patients with newly diagnosed previously untreated epilepsy. Epilep Res 1989;3:70—76.
24.DeSilva M., McArdle B., McGowan M. et al. Randomised comparative monotherapy trial of phenobarbitone, phenytoin, carbamazepine, or sodium valproate for newly diagnosed childhood epilepsy. Lancet 1996;347:9003:709—713.
25.Elger C.E., Bauer J., Scherrmann J., Widman G. Aggravation of focal epilepsies by antiepileptic drugs. Epilepsia 1998;39:Suppl 3:S15—S18.
26.Erecinska M., Cherian S., Silver I. Brain development and susceptibility to damage; ion levels and movements. Curr Top Dev Biol 2005;69:139—186.
27.French J.A. The role of new antiepileptic drugs. Am J ManCare 2001;7:2:Suppl: S209—S214.
Assessment Subcommittee of the American Academy of Neurology; Quality Standards Subcommittee of the American Academy of Neurology; American Epilepsy Society. Efficacy and tolerability of the new antiepileptic drugs II: treatment of refractory epilepsy: report of the Therapeutics and Technology Assessment Subcommittee and Quality Standards Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Neurology 2004;62:8:1261—1273.
29.Glauser T., Ben-Menachem E., Bourgeois B. et al. ILAE treatment guidelines: evidence-based analysis of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes. Epilepsia 2006;47:7:1094—1120.
30.Guberman A., Neto W., Gassmann-Mayer C. EPAJ-119 Study Group. Lowdose topiramate in adults with treatment-resistant partial-onset seizures. Acta Neurol Scand 2002;106:4:183—189.
31.Khalilov I., Le Van Quyen M., Gozlan H., Ben-Ari Y. Epileptogenic actions of GABA and fast oscillations in the developing hippocampus. Neurology 2005;48:5:787—796.
32.Korian Topiramate Study Group. Low dose and slow titration of topiramate as adjunctive therapy in refractory partial epilepsies: a multicentre open clinical trial. Seizure 2002;11:4:255—260.
33.Kwan P., Brodie M.J. Effectiveness of first antiepileptic drug. Epilepsia 2001;42:1255—1260.
34.Mares P., Slamberová R. Opposite effects of a GABA(B) antagonist in two models of epileptic seizures in developing rats. Brain Res Bull 2006;71:1— 3:160—166.
35.Marson A.G., Kadir Z.A., Hutton J.L., Chadwick D.W. The new antiepileptic drugs: a systematic review of their efficacy and tolerability. Epilepsia 1997;38:859—880.
36.Medical Research Council Antiepileptic Drug Withdrawal Study Group. Prognostic index for recurrence of seizures after remission of epilepsy. BMJ 1993;306:1374—1378.
37.Mikaeloff Y., de Saint-Martin A., Mancini J. et al. Topiramate: efficacy and tolerability in children according to epilepsy syndromes. Epilep Res 2003;53:3:225—232.
38.Mula M., Trimble M.R., Sander J.W. The role of hippocampal sclerosis in topiramate-related depression and cognitive deficits in people with epilepsy. Epilepsia 2003;44:12:1573—1577.
39.Nadkarni S., LaJoie J., Devinsky O. Current treatments of epilepsy. Neurology 2005;64:12:Suppl 3:S2—S11.
40.Nieto-Barrera M., Brozmanova M., Capovilla G. et al. Carbamazepine Study Group. A comparison of monotherapy with lamotrigine or carbamazepine in patients with newly diagnosed partial epilepsy. Epilep Res 2001;46:2:145— 155.
41.Noachtar S., Binnie C., Ebersole J. et al. A glossary of terms most commonly used by clinical electroencephalographers and proposals for the report for the EEG findings. In: Recommendations for Practice of Clinical Neurophysiology: Guidelines of International Federation of Clinical Neurophysiology. 2nd ed. Eds. G. Deuschl, A. Eisen A. Electroenceph Clin Neurophysiol 1999;Suppl 52:21—44 .
42.Reséndiz-Aparicio J.C., Rodríguez-Rodríguez E., Contreras-Bernal J. et al.
Estudio abierto aleatorio y comparativo de monoterapia con topiramato frente a carbamacepina en el tratamiento de pacientes pediátricos con epilepsia de reciente diagnóstico. Rev Neurol 2004;39:3:201—204.
43.Ritter F., Glauser T.A., Elterman R.D., Wyllie E. Effectiveness, tolerability, and safety of topiramate in children with partial-onset seizures. Topiramate YP Study Group. Epilepsia 2000;41:Suppl 1:S82—S85.
44.Sabers A., Gram L. Drug treatment of epilepsy in the 1990s. Achievements and new developments. Drugs 1996;52:4:483—493.
45.Sanchez R.M., Dai W., Levada R.E. et al. AMPA/kainate receptor-mediated downregulation of GABAergic synaptic transmission by calcineurin after seizures in the developing rat brain. J Neurosci 2005;25:13:3442—3451.
46.van Rijckevorsel K. Medical treatment of newly diagnosed epilepsy. Acta Neurol Belg 1999;99:4:226—230.
47.von Stuelpnagel C., Holthausen H., Kluger G. Long-term use of Levetiracetam in patients with severe childhood-onset epilepsy. Eur J Paediat Neurol 2007;11:6:341—345 .
48.Zhang K., Peng B.W., Sanchez R.M. Decreased IH in hippocampal area CA1 pyramidal neurons after perinatal seizure-inducing hypoxia. Epilepsia 2006;47:6:1023—1028.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 4, 2010 |
47 |
