
Журнал неврологии и психиатрии / 2010 / NEV_2010_03_083
.pdf
НАБЛЮДЕНИЕ ИЗ ПРАКТИКИ
Мерозин-дефицитная врожденная мышечная дистрофия (ВМД1А)
Д.м.н., проф. Е.Л. ДАДАЛИ1, д.м.н. Г.Е. РУДЕНСКАЯ1, к.м.н. О.А. ЩАГИНА1, Т.Б. ТИБУРКОВА1, д.м.н., проф. В.С. СУХОРУКОВ2, к.м.н. Д.А. ХАРЛАМОВ2, д.м.н., проф. А.В. ПОЛЯКОВ1
Merosin-deficient congenital muscular dystrophy (MCMD1A)
E.L. DADALI, G.E. RUDENSKAYA, O.A. SHCHAGINA, T.B. TIBURKOVA, V.S. SUKHORUKOV, D.A. KHARLAMOV, A.V. POLYAKOV
1Медико-генетический научный центр РАМН; 2Московский НИИ педиатрии и детской хирургии Росмедтехнологий
Ключевые слова: врожденная мышечная дистрофия, мутации LAMA2, мерозин, МРТ головного мозга, перивентрикулярное
белое вещество.
Key words: congenital muscular dystrophy, mutations LAMA2, merosin, MRI.
Врожденные мышечные дистрофии (ВМД) — гетеро- |
куямы» и отличающийся от последней прежде всего от- |
|
генная группа наследственных болезней мышц. Врожден- |
сутствием умственной отсталости; первые российские |
|
ное или очень раннее (до 6 мес) начало отличает ВМД от |
клинические наблюдения опубликованы в начале 1990-х |
|
других мышечных дистрофий и сближает с врожденными |
годов [1—3]. В 1994 г. в мышцах таких больных выявили |
|
структурными миопатиями; отличием от последних явля- |
дефицит белка мерозина (α2 цепь ламинина) [25], тогда же |
|
ется характер поражения мышц: если для врожденных |
картировали ген мерозина, названный LAMA2 (Laminin |
|
миопатий типичны некротические или дегенеративные |
α2) [14], а в 1995 г. у больных ВМД обнаружили мутации |
|
изменения мышечной ткани со специфичными патомор- |
LAMA2, ведущие к полному отсутствию или частичному |
|
фологическими признаками отдельных нозологических |
дефициту мерозина [13]. ВМД, связанная с LAMA2, по- |
|
форм, то при ВМД имеет место текущий миодистрофиче- |
лучила название мерозин-дефицитной или ВМД1A (MIM |
|
ский процесс, не имеющий специфичных признаков при |
607855). Большой размер гена LAMA2 (65 экзонов) и раз- |
|
«обычном» исследовании мышечного биоптата. Все ВМД |
нообразие мутаций, часть которых не выявляется рутинны- |
|
наследуются аутосомно-рецессивно и имеют тяжелое, |
ми методами, затрудняют и удорожают ДНК-диагностику |
|
глубоко инвалидизирующее течение, поэтому их клинико- |
ВМД1 А, однако в мире накоплены обширные клинико- |
|
молекулярно-генетическая диагностика чрезвычайно |
молекулярно-генетические данные. В исследовательских |
|
важна для медико-генетического консультирования. С |
целях широко используют также иммуногистохимическое |
|
развитием молекулярной генетики меняются представле- |
определение мерозина в мышцах. Как показали многочис- |
|
ния о частоте и спектре ВМД: если прежде они считались |
ленные исследования, ВМД1А встречается повсеместно, а |
|
крайне редкими, то, по современным данным, распро- |
в Европе и Америке является самой частой, составляя 30— |
|
страненность ВМД в европейских популяциях составляет |
50% всех ВМД [4, 8, 12, 17, 18, 20, 29, 30]. |
|
около 0,8 больных на 100 000 населения [18, 20], выделено |
|
В клинической практике мы диагностировали разные |
более 15 клинико-генетических форм, для большинства |
варианты ВМД, но возможность уточнения генетической |
|
идентифицированы гены. Важную роль в исследованиях и |
формы болезни и пренатальной диагностики в отягощен- |
|
практической диагностике ВМД играют также иммуноги- |
ных семьях появилась только в последние годы, когда ста- |
|
стохимические методы. Клинически ВМД подразделяют |
ла проводиться ДНК-диагностика ряда ВМД, в частности, |
|
на «чистые» формы, при которых страдает исключительно |
ВМД1А. |
|
мышечная система (вторично — костно-суставная), и |
|
Цель настоящей работы — представить первые рос- |
формы со структурным поражением ЦНС (нередко и дру- |
сийские наблюдения ВМД1А, верифицированные анали- |
|
гих органов), часть которых обозначают как синдромы. В |
зом ДНК. |
|
1960—70-х годах были описаны синдром Уокера—Варбург, |
|
Материал и методы |
исключительно «японская» ВМД Фукуямы, мышечно- |
|
|
глазо-мозговой синдром (МГМ) из числа «финских» бо- |
|
Поиск мутаций LAMA2 проведен в 5 неродственных |
лезней. По мере распространения методов нейровизуали- |
|
|
зации (КТ и МРТ) оказалось, что ВМД с вовлечением |
семьях у 6 больных (включая 2 сибсов), у которых при об- |
|
ЦНС не уникальны. В 1980-х годах в Европе и Америке |
следовании была заподозрена ВМД1А. |
|
появились описания ВМД с поражением белого вещества |
|
Выделение геномной ДНК из лейкоцитов перифери- |
мозга, названной вначале «западным вариантом ВМД Фу- |
ческой крови выполнено с помощью стандартного набора |
|
|
|
|
© Коллектив авторов, 2010 |
|
e-mail:gerud@ihome.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:3:83 |
|
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2010 |
83 |

НАБЛЮДЕНИЕ ИЗ ПРАКТИКИ
реактивов DIAtom™ DNA Prer 100 (Isogene Lab.ltd, Россия) по протоколу производителя. Полимеразную цепную реакцию (ПЦР) проводили на программируемом термоциклере МС2 («ДНК-технология», Россия) с использованием ДНК-полимеразы Biotaq («Биомастер») в объеме 25μ1 реакционной смеси. Поиск мутаций осуществляли методом прямого автоматического секвенирования по Сенгеру как с прямого, так и с обратного праймеров, на приборе ABI Prism 3100 (Applied Biosystems) с использованием протокола производителя. В качестве матрицы для секвенирования использовали фрагменты ДНК, полученные после проведения ПЦР с использованием оригинальных олигонуклеотидных праймеров (SYNTOL). Анализ результатов секвенирования проводили с помощью программ Chromas и BLAST (http://www.ncbi.nlm.nih.gov/ blast).
Клиническое обследование включало генеалогический анализ, общий и неврологический осмотр, электронейромиографию (ЭНМГ), определение активности креатинфосфокиназы (КФК) в крови, МРТ головного мозга, у 2 больных — исследование мышечного биоптата (световая и электронная микроскопия). Иммуногистохимическое исследование мерозина в мышечной ткани не проводили.
Результаты
Мутации LAMA2 обнаружены у 3 неродственных больных. Семьи П. и У. русские, родители не состоят в кровном родстве; семья С. этнически смешанная (русскотатарская); все пробанды — единственные дети в семьях. Представляем описания больных и результаты ДНКдиагностики.
Больной С. — ребенок от 1-й беременности, протекавшей с угрозой прерывания. Роды в 38 нед — экстренное кесарево сечение после длительного периода десинхронизации родовой деятельности (узкий таз у матери), в родах асфиксия плода. Масса тела при рождении — 3350 г, длина — 51 см, оценка по Апгар 7/8 баллов. С рождения отмечались выраженная мышечная гипотония и низкая двигательная активность, в связи с чем исключали спинальную амиотрофию Верднига—Гофмана. При ЭНМГ в 1,5 мес переднероговая активность и признаки первичного поражения мышц отсутствовали; выявленное снижение скоростей распространения возбуждения по периферическим нервам было расценено как физиологическая гипомиелинизация.
Впервые консультирован в Медико-генетическом научном центре (МГНЦ) в возрасте 2 мес. Отмечены выраженная диффузная мышечная гипотония, особенно в аксиальных мышцах и проксимальных мышцах конечностей, ограничение объема движений, арефлексия (синдром «вялого ребенка»), значительное переразгибание в коленных и голеностопных суставах с подвывихами, дисплазия тазобедренных суставов с подвывихом бедер. При МРТ были выявлены изменения перивентрикулярного белого вещества и гипоплазия мозолистого тела. Болезнь была расценена как последствия перинатального поражения ЦНС. В дальнейшем резко отставал в двигательном развитии: в 5 мес начал держать голову, но только при вертикальном положении тела; с 11 мес сидел, будучи посаженным, самостоятельно не садился; полностью не поворачивался, не ползал; движения в кистях были сохранны.
В психоречевом развитии имелось небольшое отставание
сположительной динамикой.
Ввозрасте 1 года 8 мес ребенок был направлен в МГНЦ вновь с подозрением на лейкодистрофию: так были расценены выраженные изменения плотности белого вещества теменно-затылочных и лобно-теменных долей при повторной МРТ. Клинически имел место выраженный проксимальный миопатический синдром без симптомов поражения ЦНС, психоэмоциональное развитие соответствовало возрасту. Было обращено внимание на повышенную активность КФК (500 Ед/л, возрастная норма до 200 Ед/л), оказавшуюся еще более высокой при повторном исследовании (850 Ед/л). Ранний тяжелый миопатический синдром с высокой КФК в сочетании с характерным поражением белого вещества мозга позволил нам диагностировать ВМД с поражением головного мозга и запланировать ДНК-диагностику (семья предполагала дальнейшее деторождение).
Первой была начата менее затратная ДНК-диагнос- тика ВМД1С (ген FKRP), при которой тоже возможна гипомиелинизация мозга. При секвенировании фрагмента экзона 4, где концентрируются мутации FKRP, изменения нуклеотидной последовательности не были обнаружены. Продолжение ДНК-диагностики семья отложила.
Позже была проведена мышечная биопсия: патоморфологическая картина с множественными некрозами и атрофией мионов без признаков структурных миопатий соответствовала ВМД. Активность КФК колебалась в пределах 1300—600 Ед/л. При повторных ЭНМГ имелись признаки первичного поражения мышц и гипо/демиелинизации периферических нервов. К 4 годам у ребенка наросла мышечная атрофия, сформировались контрактуры коленных, голеностопных, плечевых и локтевых суставов; сила в проксимальных отделах рук и ног — 2 балла; интеллект сохранный, негрубые дислалия и дизартрия.
При ДНК-диагностике ВМД1А найдены две ранее не описанные мутации LAMA2 в компаунд-гетерозиготном состоянии: с.5422С>Т (Glnl808Stop) и c.7701delTinsGTGT CCCTAGGTGTCCCTA. Первая из них — нонсенс-мута- ция, ведущая к формированию преждевременного стопкодона в экзоне 37 и нарушению формирования I и II доменов мерозина. Вторая мутация со сдвигом рамки считывания изменяет аминокислотную последовательность экзона 55, в результате чего нарушается формирование С-терминального региона.
Больная П. родилась от 2-й беременности (1-я — мертворождение), протекавшей с угрозой прерывания в I и II триместрах, выраженным токсикозом, гестозом. Роды на 36-й нед путем кесарева сечения из-за угрозы гипоксии плода. Масса тела при рождении — 3050 г, длина — 50 см, закричала сразу, оценка по шкале Апгар 8/8 баллов. На 2-е сутки взяла грудь, выписана из родильного дома на 8-е сутки. В 1,5 мес заметили снижение двигательной активности и мышечную гипотонию.
На момент первого осмотра в МГНЦ в 5 мес не держала голову, не переворачивалась, при вертикализации не опиралась на ноги; отмечены сниженная двигательная активность, диффузная мышечная гипотония, арефлексия (синдром «вялого ребенка»), формирующиеся контрактуры локтевых, коленных, голеностопных суставов и межфаланговых суставов кистей. Клиническая картина указывала на ВМД или — с меньшей вероятностью — врожденную структурную миопатию. Для уточнения диагноза
84 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2010 |

были рекомендованы мышечная биопсия и МРТ головного мозга.
При биопсии, проведенной только спустя 2 года, подтвержден диагноз ВМД: обнаружена выраженная атрофия мышечных волокон в сочетании с грубым разрастанием соединительной ткани, признаков структурных миопатий и феномена «рваных красных мышечных волокон» не найдено.
Девочка осмотрена повторно в 3,5 года. За период наблюдения не приобрела основных двигательных навыков: не переворачивается, самостоятельно не садится, не стоит. Наросли мышечные атрофии и контрактуры суставов, объем движений в конечностях минимальный, сила в мышцах рук — 3 балла, мышцах ног — 2 балла; отмечено вовлечение в процесс лицевой мускулатуры: гипотония мимических и жевательных мышц. Негрубо отстает в психоречевом развитии, речь дизартрична. Активность КФК 710 Ед/л. ЭНМГ: признаки первичного поражения мышц (значительное снижение амплитуды М-ответа с разрежением интерференционной кривой) в сочетании с признаками демиелинизирующей полинейропатии (скорость распространения возбуждения по срединному нерву снижена до 43 м/с, по большеберцовому — до 34 м/с). Эхокардиография: дилатация левого желудочка, пролапс митрального клапана, открытое овальное окно. МРТ (в 4,5 года) выявила характерную перивентрикулярную гипомиелинизацию.
При ДНК-диагностике найдены две ранее не описанные мутации LAMA2 в компаунд-гетерозиготном состоянии: С.38290Т (Argl277Stop) и c.7536delC. Первая мутация, точковая, изменяет аминокислотную последовательность экзона 26 и приводит к нарушению формирования IVa домена мерозина. Вторая мутация изменяет аминокислотную последовательность экзона 54, вследствие чего нарушается формирование С-терминального участка. Делеция одного нуклеотида в данном случае привела к образованию преждевременного стоп-кодона в положении 2546.
Больной У. обследован в МГНЦ в возрасте 6 лет. Беременность и роды протекали физиологично, оценка по Апгар 8/9 баллов, масса тела при рождении — 3600 г, длина
— 50 см. В 1-е сутки жизни выявлены кривошея и подвывих левого бедра. В 3 мес начал держать голову, никогда самостоятельно не садился, не вставал, не ходил. Уже на 1-м году жизни была выявлена повышенная активность КФК (1100 Ед/л). Наблюдался с диагнозом: миопатия.
При осмотре отмечены диффузная мышечная слабость с вовлечением мимических и жевательных мышц, гипотрофия, гипотония, арефлексия, контрактуры коленных, голеностопных, локтевых, плечевых и межфаланговых суставов, «седловидная» деформация грудной клетки (рис. 1, а). Речь имеет гнусавый оттенок вследствие арковидной деформации неба и свисания небной занавески (при сохранных глоточном и небном рефлексах). Интеллект соответствует возрасту. При МРТ головного мозга выявлены множественные очаги демиелинизации в перивентрикулярных отделах (рис. 1, б). Активность КФК в этот период нормализовалась (170 Ед/л).
При ДНК-диагностике была обнаружена одна ранее не описанная мутация LAMA2 в гетерозиготном состоянии: замена С.6406ОТ в экзоне 45, приводящая к образованию преждевременного стоп-кодона в положении 2136 (Gln2136Stop) (рис. 1, в). Хотя вторую мутацию обнаружить не удалось, с учетом типичной клинической картины подтвержден диагноз ВМД1А.
МЫШЕЧНАЯ ДИСТРОФИЯ
а
б
в
Рис. 1. ВМД1А у больного У.
а — больной 6 лет; б — МРТ: множественные очаги демиелинизации в перивентрикулярных областях; в — фрагмент электрофореграммы. Стрелкой отмечена замена С на Т в гетерозиготном состоянии, соответствующая мутации Gln2136Stop.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2010 |
85 |
НАБЛЮДЕНИЕ ИЗ ПРАКТИКИ |
|
Таким образом, 3 больных имеют сходную клиниче- |
дения МРТ мозга. При этом надо учитывать, что в периоде |
скую картину: врожденный/очень ранний тяжелый мио- |
новорожденности и первые месяцы жизни МРТ малоин- |
патический синдром с преимущественным поражением |
формативна для характеристики белого вещества из-за |
аксиальных мышц и проксимальных мышц конечностей, |
физиологической демиелинизации (как у больного С). |
высокой активностью КФК (500—1300 Ед/л), рано фор- |
Ранней диагностике может препятствовать отягощенный |
мирующимися множественными контрактурами, вовле- |
перинатальный анамнез, поначалу «маскирующий» гене- |
чением лицевых мышц (у всех больных), неспецифичны- |
тическую природу болезни (как у больных С. и П). Вместе |
ми дистрофическими изменениями мышечного биоптата |
с тем у этих больных, наблюдавшихся нами длительно, |
(у 2 обследованных) и сопутствующей демиелинизирую- |
клинический диагноз ВМД был установлен достаточно |
щей полинейропатией (у 3 обследованных); другая общая |
рано, на 1—2-м годах жизни, но уточнение ее формы было |
составляющая клинической картины — выраженные |
отсрочено, так как семья откладывала обследование. В |
стойкие изменения белого вещества головного мозга при |
дифференциальной диагностике с перинатальной пато- |
сохранном (2 больных) или негрубо задержанном (1) ум- |
логией и лейкодистрофиями помогает широко доступное |
ственном развитии, без симптомов очагового поражения |
определение активности КФК. |
ЦНС. Субклинические признаки поражения сердца у |
Наряду с типичными случаями накапливаются на- |
больной П., не носящие характера кардиомиопатии, рас- |
блюдения редких и атипичных проявлений. Во-первых, |
ценены как независимые. Другой сопутствующей патоло- |
часть больных имеет клинические проявления поражения |
гии и внешних признаков дисморфогенеза нет. |
ЦНС. По данным ряда авторов, снижение интеллекта (не- |
В семьях проведено медико-генетическое консульти- |
грубое) и/или эпилепсия наблюдаются лишь у 5—10% |
рование, разъяснен риск болезни у будущих детей (25%). |
больных). Из 26 больных, наблюдавшихся J. Oliviera и со- |
Во всех 3-х семьях возможна дородовая ДНК-диагностика |
авт. [19], 1 страдал эпилепсией и у 1 наблюдался легкий |
с комбинацией прямого и косвенного методов анализа |
интеллектуальный дефект (у последнего имелись другие |
ДНК. В семьях Д. и В. с клинической картиной ВМД1А у |
атипичные симптомы, указывающие на сочетание с неге- |
3 больных мутаций LAMA2 не найдено. |
нетической патологией). Однако К. Jones и соавт. [16], |
Обсуждение |
обобщившие все наблюдения ВМД1А, опубликованные к |
2004 г., приводят гораздо более высокую частоту сниже- |
|
Клиническая картина ВМД1А у наших больных до- |
ния интеллекта — 30%. Отчасти различия цифр могут быть |
связаны с возрастом и сроком наблюдения больных. Негру- |
|
статочно типична. Действительно, в большинстве случаев |
бая задержка психоречевого развития у нашей больной П. |
болезнь проявляется до 6 мес чаще с рождения, ее основу |
может быть связана как с основным заболеванием, так и |
составляет тяжелый прогрессирующий миопатический |
перинатальным поражением ЦНС, состояние ее интел- |
синдром с преимущественным поражением мышц туло- |
лекта требует наблюдения. Другая группа атипичных слу- |
вища и проксимальных отделов рук и ног; больные само- |
чаев отличается менее тяжелым течением миодистрофии: |
стоятельно не садятся (в лучшем случае сидят без опоры) |
более поздним началом (вплоть до 12 лет!), возможностью |
и не ходят. В ряде случаев при вовлечении мышц, участву- |
ходьбы; при поздних формах встречается псевдогипертро- |
ющих в дыхании и глотании, развиваются респираторный |
фия мышц, нехарактерная для «классического» варианта. |
дистресс-синдром и дисфагия. В начале болезни мышцы |
По обобщенным данным, относительно «мягкие» формы, |
лица не страдают, но позже у части больных возникает на- |
более сходные с конечностнопоясной миодистрофией, |
ружная офтальмоплегия. Кардиомиопатия нехарактерна. |
составляют около 12% [16]. Такие случаи чаще встречают- |
Активность КФК всегда повышена. Чаще она не превы- |
ся при частичном дефиците мерозина [9, 10, 16, 19, 23, 24]. |
шает 1500 Ед/л (как у наших больных), но может быть го- |
В выборке J. Oliviera и соавт. [19] самостоятельно ходили |
раздо более высокой: так, у 26 больных 9 мес — 24 лет, на- |
3 больных 18, 20 и 24 лет; 2 из них имели частичную недо- |
блюдавшихся J. Oliviera и соавт. [19], наибольшие зареги- |
статочность мерозина, а генотипически — компаунд- |
стрированные показатели КФК варьировали в интервале |
гетерозиготность по мутации, ведущей к обрыву белка с |
600—7000 Ед/л. С возрастом активность КФК снижается |
полной инактивацией, и миссенс-мутации, обеспечиваю- |
(как у больного У.), что отражает далеко зашедший про- |
щей его остаточную активность (у 3-го больного иммуно- |
цесс и значительную утрату мышечной массы. Типичны |
гистохимическое исследование не проводилось). С. Di |
ранние контрактуры крупных суставов и межфаланговых |
Blasi и соавт. [10, 11] описали 29-летнего больного с позд- |
суставов кисти. Характерна демиелинизирующая поли- |
ним началом болезни, частичным дефицитом мерозина и |
нейропатия, которая может не проявляться клинически и |
атипичной картиной мышечного биоптата, напоминав- |
не всегда регистрируется при ЭНМГ. Отличительный и |
шей миозит с включениями (редкая форма полимиозита с |
диагностически очень важный признак — поражение бе- |
дистальной слабостью). Больная с гомозиготностью по |
лого вещества головного мозга, выявляемое при КТ и осо- |
делеции со сдвигом рамки считывания в экзоне 56 и сле- |
бенно при МРТ (гипо- и гиперинтенсивный сигналы от |
довым количеством мерозина при гистохимическом ис- |
белого вещества в режимах Т1 и Т2 соответственно); наи- |
следовании ходила в 13 лет [22]. Возможность ходьбы |
более типично двустороннее поражение перивентрику- |
описана и у больных с полным отсутствием мерозина. |
лярного белого вещества теменных, лобных и височных |
Необычное течение ВМД1А наблюдали P. Vigliano с соавт. |
отделов [15]. Эти выраженные и стойкие изменения, как |
[27]: больная с полным отсутствием мерозина и гомози- |
правило, не вызывают очаговой неврологической сим- |
готностью по нонсенс-мутации LAMA2 ходила самостоя- |
птоматики, не сопровождаются снижением интеллекта и |
тельно до 7 лет, когда начались эпилепсия и деменция, |
расстройствами психики, т.е. бессимптомны (как у боль- |
после чего утратила способность ходьбы; при МРТ, кроме |
ных С. и У). Поэтому подозрение на ВМД даже без сим- |
поражения белого вещества, выявлялась распространен- |
птомов поражения ЦНС является показанием для прове- |
ная двусторонняя затылочная микрополигирия. Этот слу- |
86 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2010 |

МЫШЕЧНАЯ ДИСТРОФИЯ
чай иллюстрирует также достаточное разнообразие МРТкартины при ВМД1 А. Действительно, помимо изменений белого вещества (степень и локализация которых варьируют), описаны локальная дисплазия коры (пахигирия, микрополигирия), гипоплазия червя мозжечка, мозолистого тела, гипофиза [5, 7, 17, 19, 21]; как и поражение белого вещества, эти дополнительные МРТ-признаки чаще не проявляются клинически. Наконец, известны случаи ВМД1А без изменений МРТ [16, 23]. Таким образом, клинический спектр ВМД1А значительно шире, чем предполагалось. Это надо учитывать при отборе больных для молекулярно-генетической и иммуногистохимической диагностики, не ограничиваясь «классическим» фенотипом.
Продолжительность жизни при ВМД1А варьирует от нескольких лет при очень тяжелых формах до 30 лет и более. Специфичного лечения нет.
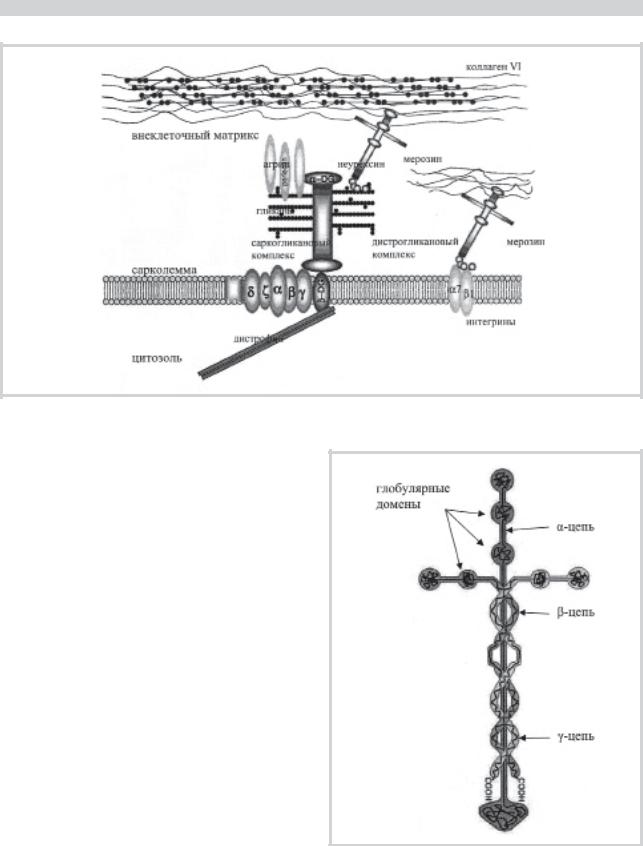
Таблица позволяет сравнить ВМД1А и другие ВМД с поражением головного мозга (в таблицу не включены их общие признаки: тяжелый миопатический синдром и ранние контрактуры). Видно, что синдромальные ВМД (Фукуямы, Уокера-Варбург и МЕВ) имеют большое сходство, тогда как ВМД1А значительно отличается от них, особенно по степени поражения ЦНС. За сходством трех синдромальных форм стоит их патогенетическая близость: все соответствующие гены кодируют ферменты, обеспечивающие гликозилирование α-дистрогликана (эти ВМД называют также дистрогликанопатиями). Мерозин же принадлежит к структурным белкам базальной мембраны и экстрацеллюлярного матрикса, что сближает ВМД1А с рядом «чистых» ВМД, гены которых кодируют белки той же группы (трех цепей коллагена 6-го типа, интегрина 7-типа). Эти белки тесно взаимодействуют между собой (рис. 2).
Клинические признаки ВМД1А находят объяснение в характеристиках гена и белка: очень раннее начало большинства случаев объясняется участием мерозина в формировании мышечных волокон в эмбриогенезе; полинейропатия и демиелинизация головного мозга при ВМД1А отражают экспрессию LAMA2 не только в поперечнополосатых мышцах (базальной мембране), но также в периферических нервах и ЦНС (главным образом в шванновских клетках и синаптических структурах).
Полипептидная цепь мерозина включает 3088 аминокислот и 22 сигнальные последовательности и имеет доменную структуру. 6 белковых доменов выполняют специфические функции в белковой молекуле. В мышечном волокне мерозин локализован в экстрацеллюлярном матриксе и обеспечивает сцепление белков сарколеммы и коллагеновых волокон. Он представляет собой гетеротример, состоящий из трех полипептидных цепей — тяжелой цепи α2 и двух легких цепей β1 и γ1. Выделяют длинное плечо и 3 коротких плеча мерозина. Длинное плечо сформировано 3 закрученными вдоль оси полипептидными цепями и стабилизируется дисульфидными связями и взаимодействует с белками дистрогликанового комплекса саркомеры мышечных волокон. Короткие плечи формируют крестообразную структуру и обеспечивают связь мерозина с коллагеном 6-го типа межклеточных пространств (рис. 3). Предполагается, что основная функция ламинина α2 заключается в обеспечении сцепления и правильной ориентации миофибрилл мышечного волокна посредством его взаимодействия с коллагеновыми структурами межклеточных пространств и белками сарколеммы.
Другие симптомы
МРТ мозга
Течение
Эпидемиология
|
Ген, белок |
ВМД с поражением головного мозга |
Нозологическая форма, MIM |
Эпилепсия (8—20%); лег- |
кая олигофрения (5— |
30%) |
Олигофрения; эпилепсия |
(50%); аномалии глаз (ча- |
ще нетяжелые) |
Олигофрения; эпилеп- |
сия; различные аномалии |
глаз; другие ВПР (реже) |
Олигофрения; эпилеп- |
сия; различные аномалии |
глаз |
Редко легкая олигофре- |
ния, микроцефалия |
Глубокая олигофрения |
|
|
Поражение белого вещества, |
больше перивентрикулярно |
|
Лизэнцефалия II, агенезия |
срединных структур, гипо- |
миелинизация и другие ВПР |
Лизэнцефалия II, гидроце- |
фалия, ВПР мозжечка, аге- |
незия срединных структур и другие ВПР |
Лизэнцефалия II, гидроце- |
фалия, ВПР мозжечка, аге- |
незия срединных структур и другие ВПР |
В части случаев: аномалии |
мозжечка, гипомиелинизация |
Поражение белого вещества, |
нарушение нейрональной |
миграции, гипоплазия ствола |
Многие больные доживают |
до 15—30 лет, почти все |
больные не ходят |
Некоторые больные пережи- |
вают 1-е десятилетие, почти |
все не ходят |
Большинство больных уми- |
рают на 1-м году, 5—10% пе- |
реживают 5 лет |
Больные живут немного |
дольше, чем при синдроме |
Уокера—Варбург |
Продолжительность жизни |
варьирует |
Больная обследована в 17 лет |
|
|
Самая частая ВМД в |
странах Запада (30%), |
редкая в Азии |
Частота в Японии |
1:10 000 |
|
Встречается повсемест- |
но |
|
Частота в Финляндии |
1:52 000; встречается |
повсеместно |
Редкие случаи в разных |
странах |
Описан один случай |
|
|
LAMA2, мерозин |
|
|
FKTN, фукутин |
|
|
POMT1, POMT2, О-маннозил- |
трансферазы 1 и 2 |
|
POMGNT1, O-манноза-бета1,2-N- |
ацетилглюкозаминил-трансфераза |
|
FKRP, фукутин-связанный белок |
|
LARGE, |
ацетилглюкозаминилтрансфераза- |
подобный |
ВМД1А (мерозин- |
дефицитная), 607855 |
|
ВМД Фукуямы, 253800 |
|
|
Синдром Уокера— |
Варбург, 236670 |
|
Мышечно-глазо- |
мозговой синдром |
(MEB), 253280 |
ВМД1С, 606612 |
|
ВМД1D, 608840 |
|
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2010 |
87 |
НАБЛЮДЕНИЕ ИЗ ПРАКТИКИ
Рис. 2. Взаимодействие мерозина (ламинина α2) c другими белками сарколеммы.
Взаимодействие мерозина с белками сарколеммы осуществляется с помощью 2 механизмов. С одной стороны, он является лигандом α-дистрогликанов, входящих в дистрофин-гликопротеиновый комплекс, с другой — он взаимодействует с мембранным рецептором миофибрилл
—интегрином (см. рис. 3).
Внастоящее время зарегистрировано более 200 мутаций LAMA2 у почти 600 больных [15, 28]. Наиболее типичны делеции и мутации, приводящие к образованию стоп-кодона (как и в наших наблюдениях), тогда как миссенс-мутации редки. Имеются гено-фенотипические корреляции: при легком течении болезни чаще обнаруживают мутации без сдвига рамки считывания [15, 28]. Доля молекулярно-генетически подтвержденных случаев у больных с предварительным клиническим диагнозом ВМД1А в разных исследованиях варьирует. В выборке J. Oliviera и соавт. [19] она очень высока: 96% (25 из 26 больных). Это обеспечивается не только строгим отбором больных (у большинства предварительно проведено иммуногистохимическое исследование), но и применением широкого спектра методов ДНК-анализа, что позволило наряду с точковыми мутациями и малыми делециями и инсерциями обнаружить крупную делецию гена у 8 больных. Рутинные же методы анализа ДНК не выявляют атипичные мутации LAMA2 (в частности, крупные делеции), доля которых достигает 30—40%. Этим объясняется «отсутствие» второй мутации у больного У. В семьях Д. и В., где мутации не были обнаружены, также возможна ВМД1А с атипичными мутациями LAMA2. В подобных случаях для подтверждения диагноза проводят иммуногистохимическое исследование мерозина в мышечной ткани. При верифицированном диагнозе возможна дородовая ДНКдиагностика с использованием косвенных методов. Отметим, что дефицит мерозина в мышцах сам по себе не патогномоничен для ВМД1 А. В частности, он выявлен при
Рис. 3. Строение ламининов.
ВМД1В [6]. Эта «чистая» ВМД описана всего в 2 семьях разной этнической принадлежности, ген картирован в локусе lq42. Авторы считают, что дефицит мерозина в обеих семьях носит вторичный характер и косвенно указывает
88 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2010 |

МЫШЕЧНАЯ ДИСТРОФИЯ
на связь ВМД 1В с одним из белков, взаимодействующих с мерозином. Возможность неспецифичного дефицита мерозина надо учитывать при иммуногистохимических исследованиях.
Таким образом, в диагностике и дородовой диагностике ВМД1А наиболее надежен комплексный подход, сочетающий иммуногистохимические методы, прямые и косвенные методы ДНК-анализа. В мире накоплен значи-
тельный опыт пренатальной диагностики ВМД1А. M. Vainzhof и соавт. [26] обобщили материал 5 центров, где за 1995—2004 гг. было проведено 114 пренатальных исследований: комплексный подход обеспечил высокую надежность диагностики без ложноположительных и ложноотрицательных результатов. Основой генетической профилактики ВМД1А в отягощенных семьях является ее своевременная диагностика у больных.
ЛИТЕРАТУРА
1.Аверьянов Ю.Н. Врожденная мышечная дистрофия с лейкоэнцефало16. Jones K., Morgan G., Johnston H. et al. The expanding phenotype of laminin
патией. Журн неврол психиат 1993; 5: 27—29.
2.Руденская Г.Е., Галкина В.А., Дунаевская Г.Н. Редкие формы наследственных прогрессирующих мышечных дистрофий с контрактурами. Теоретические и прикладные проблемы мед. генетики. М 1993; 105— 119.
3.Руденская Г.Е., Дадали Е.Л., Ситников В.Ф. Наследственная сочетанная церебро-мышечная патология в детском возрасте. Организационные и клинические проблемы детской неврологии и психиатрии. М 1993; 253—255.
4.Allamand V., Guicheney P. Merosin-deficient congenital muscular dystrophy, autosomal recessive (MDC1A, MIM #156225, LAMA2 gene coding for α2 chain of laminin). Neurology 2002; 10: 91—94.
5.Barkovich A. Pediatric Neuroimaging Lippincott, Williams and Wilkins, 4th Ed. 2005.
6.Brockington M., Sewry C., Herrmann R. et al. Assignment of a form of congenital muscular dystrophy with secondary merosin deficiency to chromosome 1q42. Am J Hum Genet 2000; 66: 428—435.
7.Buteica E., Rosulescu E., Burada F. et al. Merosin-deficient congenital muscular dystrophy type 1A. Rom J Morphol Embryol 2008; 49: 229—233.
8.Chae J., Lee J., Hwang H. et al. Merosin-deficient congenital muscular dystrophy in Korea. Brain Dev 2009; 31:341—346.
α2 chain (merosin) abnormalities: case series and review. J Med Genet 2001;
38: 649—657.
17.Leite C., Lucato L., Martin M. Merosin-deficient congenital muscular dystrophy (CMD): a study of 25 Brazilian patients using MRI. Pediat Radiol 2005; 35: 572—579.
18.Lisi M., Cohn R. Congenital muscular dystrophies: new aspects of an expanding group of disorders. Biochim Biophys Acta 2007; 1772: 159—172.
19.Oliviera J., Santos R., Soares-Silva I. et al. LAMA2 gene analysis in a cohort of 26 congenital muscular dystrophy patients. Clin Genet 2008; 74: 502— 512.
20.Peat R., Smith J., Compton A. et al. Diagnosis and etiology of congenital muscular dystrophy. Neurology 2008; 71: 312—321.
21.Philpot J., Cowan F., Pennock J. et al. Merosin-deficient congenital muscular dystrophy: the spectrum of brain involvement on magnetic resonance imaging. Neuromuscul Disord 1999; 9: 81—85.
22.Prandini P., Berardinelli A., Fanin M. et al. LAMA2 loss-of- function mutation in a girl with congenital muscular dystrophy. Neurology 2004; 63: 1118—1121.
23.Sewry C., Naom I., D’Alessandro M. et al. Variable clinical phenotype in merosin-deficient congenital muscular dystrophy associated with differen-
tial immunolabeling of two fragments of the laminin α2 chain. Neuromuscul Disord 1997; 7: 169—175.
9.Cohn R., Hermann R., Sorokin L. et al. Laminin α2 chain-deficient con24. Tezak Z., Prandini P., Boscaro M. et al. Clinical and molecular study in con-
genital muscular dystrophy. Variable epitope expression in severe and mild cases. Neurology 1998; 51: 94—100.
10.Di Blasi C., Mora M., Pareyson D. et al. Partial laminin α2 chain deficiency in a patient with myopathy resembling inclusion body myositis. Ann Neurol 2000; 47: 811—816.
11.Di Blasi C., Piga D., Brioschi P. et al. LAMA2 gene analysis in congenital muscular dystrophy. New mutations, prenatal diagnosis, and founder effect. Neurology 2005; 62: 1582—1586.
12.Habeeb Y., Al-Jumah E., De Souza T. Congenital muscular dystrophy in Arab children. J Child Neurol 2006; 21: 400—405.
13.Helbling-Leclerc A., Zhang X., Topaloglu H. et al. Mutations in the laminin alpha 2-chain gene (LAMA2) cause merosin-deficient congenital muscular dystrophy. Nat Genet 1995; 11: 216—218.
14.Hillaire D., Leclerc A., Faure S. et al. Localization of merosin-negative congenital muscular dystrophy to chromosome 6q2 by homozygosity mapping. Hum Mol Genet 1994; 3: 1657—1661.
15.Human Gene Mutation Database at the Institute of Medical Genetics in Cardiff (HGMD): http://www.hgmd.cf.ac.uk/ac/index.php
genital muscular dystrophy with partial laminin alpha2 (LAMA2) deficiency. Hum Mutat 2003; 21: 103—111.
25.Tome F., Evangelista T., Leclerc A. et al. Congenital muscular dystrophy with merosin deficiency. С R Acad Sci III 1994; 317: 351—357.
26.Vainzhof M., Richard P., Hermann R. et al. Prenatal diagnosis of laminin alpha2 chain (merosin)-deficient congenital muscular dystrophy: a collective experience if five international centers. Neuromuscul Disord 2005; 15: 588—594.
27.Vigliano P., Dassi P., Blasi C. et al. LAMA2 stop-codon mutation: merosindeficient congenital muscular dystrophy with occipital polymicrogyria, epilepsy and psychomotor regression. Eur J Paediat Neurol 2009; 13: 72—76.
28.Washington University Neuromuscular Disease Database: http://neuromuscular.wustl.edu
29.Xiong H., Yao S., Yuan Y. et al. Diagnosis of congenital muscular dystrophy and clinical significance of merosin expression. Zhonghua Er Ke Za Zhl 2006; 44: 918—923.
30.Yuan J., Takashima H., Higuchi I. et al. Genetically confirmed patients with merosin-deficient congenital muscular dystrophy in China. Neuropediatrics 2008; 39: 264—267.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 3, 2010 |
89 |
