
- •1. Тепловое излучение. Основные характеристики теплового излучения. Абсолютно черное тело. Закон Кирхгофа
- •2. Законы излучения абсолютно черного тела (Стефана – Больцмана и Вина). Гипотеза и формула Планка для абсолютно черного тела
- •3. Фотоны. Энергия, масса и импульс фотона
- •4. Внешний фотоэффект. Вольтамперная характеристика фотоэффекта. Законы Столетова. Уравнение Эйнштейна
- •5. Давление света
- •6. Комптон – эффект и его объяснение
- •7. Корпускулярно-волновой дуализм материи. Гипотеза де Бройля, ее экспериментальное подтверждение.
- •8. Волны де Бройля. Статистический смысл волн де Бройля, свойства волн.
- •9. Соотношения неопределенностей Гейзенберга, их физическое содержание
- •10. Статистический смысл и свойства волновой функции. Уравнение Шредингера в стационарной форме, смысл входящих величин
- •11. Частица в бесконечно глубокой одномерной потенциальной яме. Квантование энергии частицы. Собственные значения волновой функции
- •14. Туннельный эффект. Коэффициент прозрачности барьера
- •15. Квантово-механический осциллятор
- •16. Модель атома Бора. Постулаты Бора. Спектр излучения атома водорода. Недостатки теории Бора. Опыт Франка – Герца
- •17. Квантовомеханическая теория атома водорода. Уравнение Шредингера для атома водорода, анализ его решения. Собственные значения энергии электрона в атоме. Потенциал ионизации
- •18. Квантование энергии, момента импульса и проекции момента импульса электрона в атоме водорода
- •19. Кратность вырождения уровней энергий. Символика обозначения квантовых состояний
- •20. Магнитные свойства атома. Спин электрона. Орбитальные и спиновые характеристики электрона в атоме. Опыт Штерна – Герлаха
- •21. Полный набор квантовых чисел электронов в атоме, их физический смысл
- •22. Спектр излучения атома водорода. Правила отбора квантовых чисел. Серии излучения атома водорода
- •23. Символика обозначений квантовых состояний. Понятие о вырождении. Принцип Паули. Периодическая система Менделеева
8. Волны де Бройля. Статистический смысл волн де Бройля, свойства волн.
Волны
де Бройля
— волны, связанные с любой микрочастицей
и отражающие их квантовую природу. Любая
движущаяся частица (например, электрон)
ведёт себя не только как локализованный
в пространстве перемещающийся объект
- корпускула, но и как волна, причём длина
этой волны даётся формулой
![]() =
h/р, где h = 6.6.10-34 Дж.сек
– постоянная Планка, а р – импульс
частицы. Эта волна и получила название
волны де Бройля.
=
h/р, где h = 6.6.10-34 Дж.сек
– постоянная Планка, а р – импульс
частицы. Эта волна и получила название
волны де Бройля.
Согласно статистической интерпретации волны де Бройля следует рассматривать как волны вероятности. Более определенно: интенсивность волны де Бройля в каком-либо месте пространства пропорциональна вероятности обнаружить частицу в этом месте.
Свойства волн де Бройля:
1) Фазовая скорость волны де Бройля вычисляется в результате дифференцирования этого уравнения по времени: E – p dx/dt = 0,. υф = dx/dt = E/p = mc2/mυ = c c/υ, где υ-скорость частицы. Т.к. υ<c, то фазовая скорость волн де Бройля всегда больше скорости света в вакууме, т.е. υф > c.
Это соотношение отражает особое специфическое свойство волн де Бройля.
2) Групповая скорость волн де Бройля равна скорости движения частиц: υr = ds/dt = υ.
3) Длинам боровских орбит соответствуют стоячие волны де Бройля, т.е. в длину боровской орбиты укладывается целое число стоячих волн де Бройля: 2πrn = nλ.
9. Соотношения неопределенностей Гейзенберга, их физическое содержание
Принцип неопределённости Гейзенберга - в квантовой механике так называют принцип, дающий нижний (ненулевой) предел для произведения дисперсий величин, характеризующих состояние системы.
Соотношения неопределённости Гейзенберга — это теоретический предел точности любых измерений. Они справедливы для так называемых идеальных измерений, иногда называемых измерениями фон Неймана. Они тем более справедливы для неидеальных измерений или измерений Ландау.
Соответственно, любая частица (в общем смысле, например несущая дискретный электрический заряд) не может быть описана одновременно как «классическая точечная частица» и как волна. (Сам факт того, что какое-либо из этих описаний может быть справедливо, по крайней мере в отдельных случаях, называют корпускулярно-волновым дуализмом). Принцип неопределённости, в виде, первоначально предложенном Гейзенбергом, верен в случае, когда ни одно из этих двух описаний не является полностью и исключительно подходящим, например частица в коробке с определённым значением энергии; то есть для систем, которые не характеризуются ни каким-либо определённым «положением» (какое-либо определённое значение расстояния от потенциальной стенки), ни каким-либо определённым значением импульса (включая его направление).
Соотношение
неопределенности Гейзенберга показывает,
что “между точностью, с которой
одновременно может быть установлено
положение частицы, и точностью ее
импульса существует определенное
соотношение”:
![]() q
q
![]() p
≥ h
,
p
≥ h
,
где
![]() - среднеквадратичное отклонение.
- среднеквадратичное отклонение.
10. Статистический смысл и свойства волновой функции. Уравнение Шредингера в стационарной форме, смысл входящих величин
Волновая функция имеет статистический смысл: квадрат модуля волновой функции определяет плотность вероятности нахождения частицы (электрона): dw/dV = |Ψ|2.
Здесь dw вероятность нахождения частицы в элементе объема от V до V+dV.
Свойства волновой функции:
1) Правило нормировки:
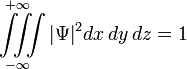
Правило выражает тот факт, что вероятность обнаружить частицу с данной волновой функцией во всем пространстве равна единице.
2) Импульс частицы в каждом из направлений x, y, z пропорционален первой производной волновой функции, делённой на саму волновую функцию, а именно:
![]()
![]()
![]()
где px , py , pz — проекции импульсов на соответствующие оси координат, i = √-1 - мнимая единица, ħ = h/2π - постоянная Планка.
3)
Кинетическая
энергия
частицы (p2x
+
p2y
+ p2z)
/ 2m
пропорциональна
второй производной, или кривизне
волновой функции, деленной на эту
волновую функцию
![]() .
.
Стационарное уравнение Шредингера для движения электрона в кулоновском поле ядра атома водорода и водородоподобных атомов имеет вид: ∆ψ + (8π2m/h2)(E-U)Ψ = 0,
где Ψ – волновая функция, ∆ - оператор Лапласа, Е – полная энергия электрона в атоме, U = -(Ze2/4πε0r) – потенциальная энергия.
