
- •Основные типы и механизмы реакций в органической химии
- •Тема I: классификация химических реакций.
- •Вопросы и упражнения
- •Тема II. Реакционная способность спиртов, фенолов, аминов, альдегидов, кетонов, карбоновых кислот.
- •Тема III. Окисление и восстановление органических соединений. Мотивационная характеристика темы
- •Учебная цель
- •Вопросы и упражнения
- •Контрольные вопросы:
- •Список рекомендованной литературы
- •Учебное издание
Тема II. Реакционная способность спиртов, фенолов, аминов, альдегидов, кетонов, карбоновых кислот.
Исходный уровень
1. Электроотрицательность элементов.
2. Полярность и поляризованность связей.
3. Строение π-связи.
4. Электронные эффекты заместителей.
5. Типы реагентов. Переходное состояние. Строение карбкатиона и карбаниона. Факторы, которые влияют на их стабильность.
6. Кислотность и основность органических соединений.
Практические навыки
1. Уметь прогнозировать реакционную способность разных классов органических соединений в реакциях нуклеофильного замещения, присоединения, элиминирования.
2. Научиться получать хлористый этил, проводить реакции дегидратации спиртов, выполнять качественные реакции на ацетон.
Контрольные вопросы
1. Приведите механизмы реакций взаимодействия пропилового спирта с бромоводородом и дегидратацией пропилового спирта. Обоснуйте необходимость кислотного катализа.
2. Получите этиловый полуацеталь пропионового альдегида; имин из метиламина и уксусного альдегида; неполный и полный амид малоновой кислоты.
Учебные задачи и алгоритмы их решения
Задача № 1. Получите этанол и этилен с хлорэтана.
Алгоритм
решения.
В молекуле хлорэтана есть полярная
ковалентная связь
![]() ,
в связи с чем во время атаки нуклеофильним
реагентом (анионом, например,
,
в связи с чем во время атаки нуклеофильним
реагентом (анионом, например,![]() и другими) возможен ее гетеролитический
разрыв и замещения одного нуклеофила
другим, т.е. в данном случае возможная
реакция нуклеофильного замещения –SN
реакция.
Источником OH-
ионов
является водный раствор
KOH
.
и другими) возможен ее гетеролитический
разрыв и замещения одного нуклеофила
другим, т.е. в данном случае возможная
реакция нуклеофильного замещения –SN
реакция.
Источником OH-
ионов
является водный раствор
KOH
.
Уместно будет предположить, что эта реакция должна протекать за ионным механизмом. Однако не всегда отдельные стадии реакции бывают разграниченные достаточно четко. Во время трактования механизмов реакций часто используют понятие "переходное состояние" (активированный комплекс), который характеризуется тем, что промежуточный продукт реакции имеет схожесть как с исходным веществом, так и с продуктом реакции.
При действии на галогенуглеводородные водного раствора щелочей гидроксильный ион атакует положительно заряженный атом углеводорода со стороны, противоположной отрицательному атому галогена:

Активированный комплекс или переходное состояние
При наличии достаточной энергии ион OH- приближается на такое расстояние, при котором между ним и атомом углерода начинает образовываться связь, а между атомом углерода и галогеном связь ослабляется. В активированном комплексе, который образовался, атом углерода находится в состоянии sp2-гибридизации и этот комплекс имеет плоскостное строение. Потом связь между углеродом и галогеном разрывается и образуется спирт. Реакция протекает в мягких условиях в связи с тем, что Cl- более стабильный, чем OH- ион, который вступает в реакцию, т.е. относится к группам, которые легко отходят. На основе SN реакций с помощью галогенпроизводных получают гормон адреналин, сосудосуживающий препарат эфедрин, спазматическое средство тетамон, природные α-гидроксикислоти и другие вещества, которые принимают участие в процессах жизнедеятельности.
Конкурирующими по отношению к SN реакциям есть реакции элиминирования (отщепления), что обозначают E-реакции. Так, при действии на алкилгалогениды спиртового раствора щелочи происходит отщепление галоген водорода и образовываются ненасыщенные углеводороды. В этом случае нуклеофил, который в то же время является сильной основой, атакует атом водорода в β-углеродного атома, на котором из-за –I-эффекта галогена также возникает частичный положительный заряд (С-Н-кислотность). Реакция протекает через стадию образования активированного комплекса.
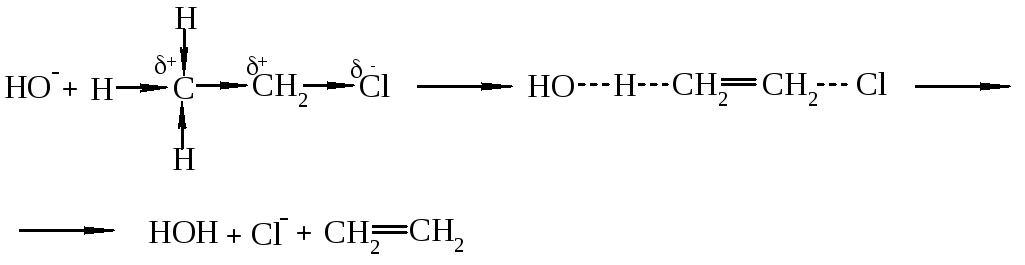
Задача № 2. Получите адреналин из нон адреналина іn vіtro.
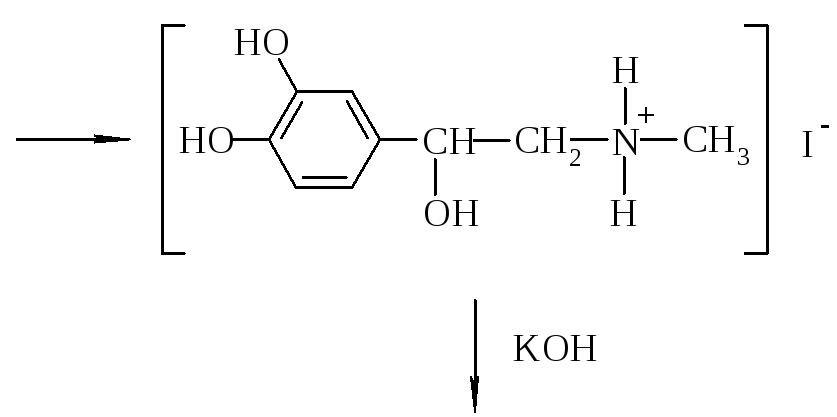
Алгоритм решения. В основе процесса лежит SN реакция, которая протекает через стадию образования переходного состояния. Поскольку к молекуле нонадреналина входит алкильний радикал, реакция называется алкилированием. В качестве алкилирующих средств используют галогенпроизводные углеводородов. В нашем случае это йодистый метил.
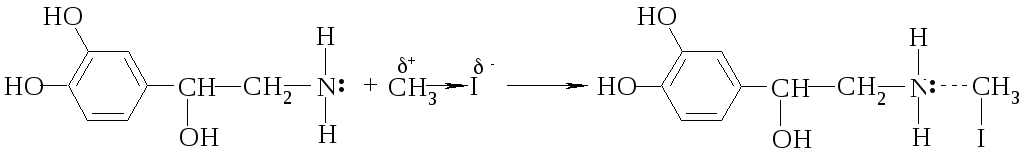
Норадреналин
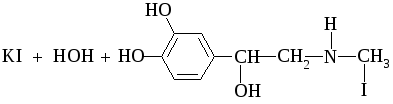
Адреналин
Задача № 3. Опишите механизм реакции образования хлорэтила (местного обезболивающего) конкурентную ей реакцию элиминирования.
Алгоритм решения. У SN реакциях спиртов гидроксильная группа может быть замещена нуклеофилом, например, галогеном. Реакция нуклеофильного замещение осуществляется только при условии, что ион или молекула, которая отходит, более стабильная, чем та, что вступает. Так как OH- ион менее стабильный, чем Cl-, необходим кислотный катализ, вследствие чего OH- ион, который тяжело отходит, превращается в молекулу H2O, которая легко отходит. В этом случае на первой стадии происходит присоединение протона за счет неподелимой пары электронов атому кислорода:

Оксониевое основание, которое образовалось, находится в равновесии с карбкатином:
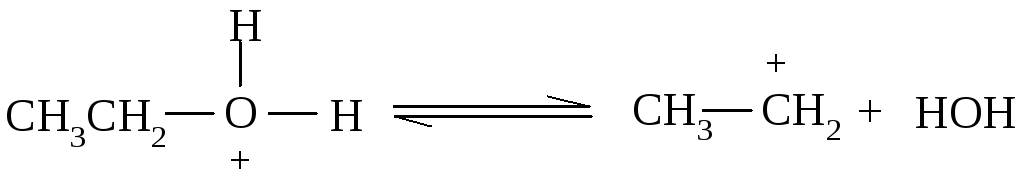
который стабилизируется за счет взаимодействия с нуклеофильною частицей Cl- ионом:
![]()
В организме замещения спиртовой гидроксильной группы осуществляется через стадию преобразования в эфиры фосфорной, дифосфорной или трифосфорной кислот, так как эфиры этих кислот - группы, которые легко отходят:

Как и в галогенпроизводных, у спиртов реакции нуклеофильного замещения конкурируют с реакциями элиминирования. Так, во время нагревания спирта с концентрированной серной кислотой происходит дегидратация и образуется этиленовые углеводороды:
![]()
В этом случае карбкатионы, которые образовались, стабилизируются, выделяя протон:
![]()
Задача № 4. Приведите механизмы реакций взаимодействия уксусного альдегида и этилового спирта в кислой среде.
Алгоритм
решения.
В карбонильной группе ![]() атом углерода находится в состоянии
sp2-гибридизации,
т.е. образует
три σ-связи, которые лежат в одной
плоскости под углом 120°С. Атомы углерода
и кислорода связаны между собой также
π-связью, которая лежит в плоскости,
перпендикулярной плоскости размещения
σ-связей.
атом углерода находится в состоянии
sp2-гибридизации,
т.е. образует
три σ-связи, которые лежат в одной
плоскости под углом 120°С. Атомы углерода
и кислорода связаны между собой также
π-связью, которая лежит в плоскости,
перпендикулярной плоскости размещения
σ-связей.
Вследствие
большей электроотрицательности атома
кислорода электроны ![]() связи
(преимущественно π-электроны) смещены
к нему, двойная связь поляризуется таким
образом, который у атома углерода
возникает уменьшенная электронная
плотность, а у атома кислорода увеличенная
электронная плотность:
связи
(преимущественно π-электроны) смещены
к нему, двойная связь поляризуется таким
образом, который у атома углерода
возникает уменьшенная электронная
плотность, а у атома кислорода увеличенная
электронная плотность:
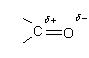 Поэтому
в данном случае π-связь должна легко
разрываться под действием полярных
агентов и для карбонильных соединений
характерны реакции нуклеофильного
присоединения (АN):
Поэтому
в данном случае π-связь должна легко
разрываться под действием полярных
агентов и для карбонильных соединений
характерны реакции нуклеофильного
присоединения (АN):
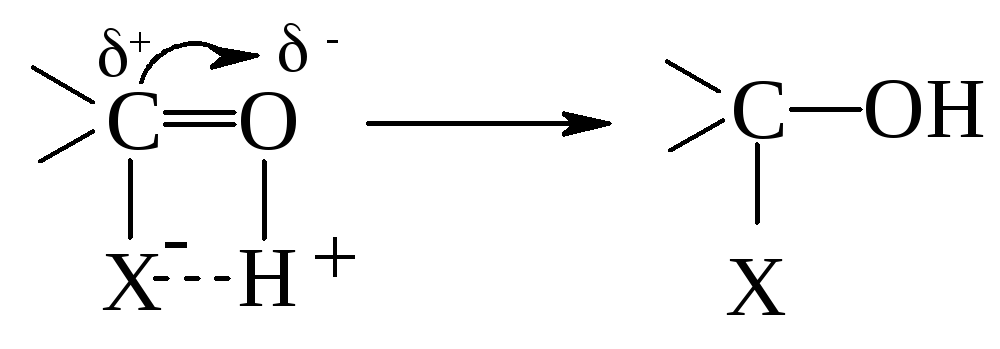
Часто реакции нуклеофильного присоединения катализируются кислотами, которые превращают молекулу в карбкатион за счет присоединения протона:
![]()
Именно так в присутствии сильных кислот начинается реакция присоединения спиртов к альдегидам.
Карбкатион, который образовался, присоединяется к молекуле спирта за счет неподеленной пары электронов атому кислорода, а производное оксония, что образовалось, стабилизируется, отделяя протон:
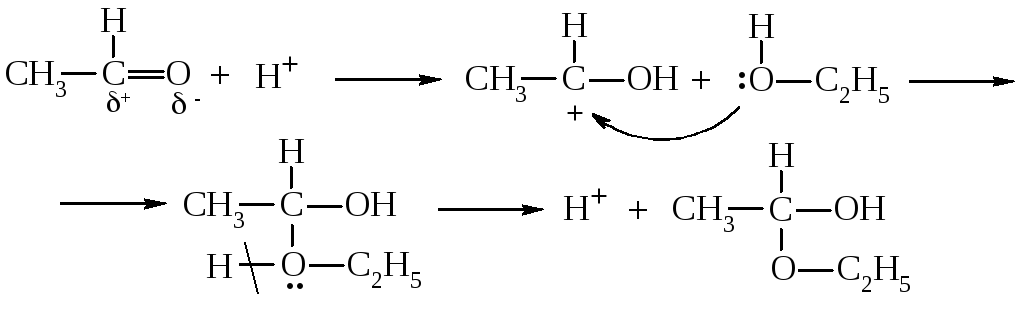
Этот продукт имеет название полуацеталь. При взаимодействии полуацеталя со второй молекулой спирта в присутствии кислоты получают ацетали:
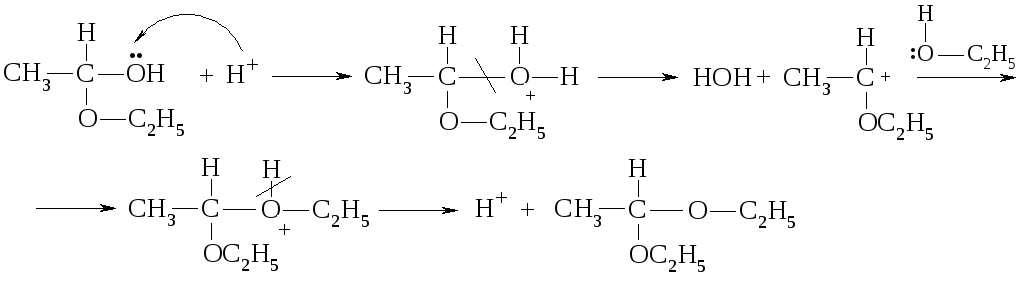 ацеталь
ацеталь
Наличие циклических форм моносахаридов объясняется образованием внутренних полуацеталей.
Присоединение спиртов к кетонам происходит тяжелее, чем к альдегидам. Производные кетонов, аналогичные ацеталям, называют кеталями:

Задача № 5. Охарактеризуйте механизм реакции взаимодействия карбонильных соединений с аминами и гидразинами.
Алгоритм решения. Альдегиды и кетоны вступают в реакции, которые могут рассматриваться как реакции замещения кислорода карбоксильной группы. Однако они в большинстве случаев протекают в две стадии: сначала происходит присоединение за счет разрыва π-связи, а потом отщепления молекулы воды (реакция присоединения-отщепления). В большинстве случаев реакция катализируется кислотой:
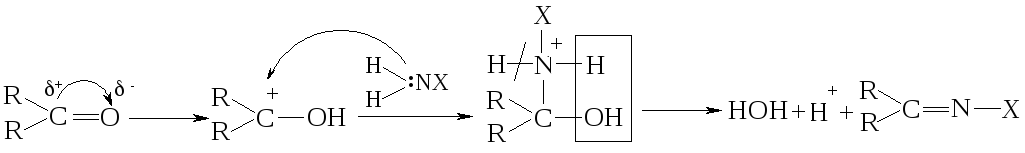
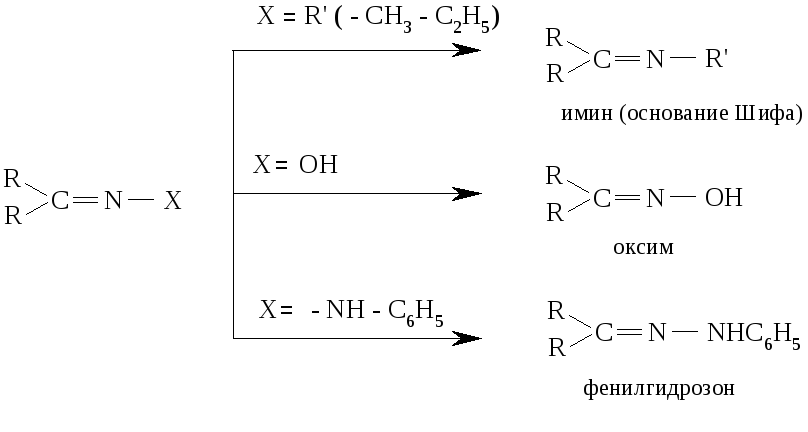
Имины (основания Шифа), которые образовались вследствие реакции, являются промежуточными продуктами во многих ферментативных процессах. В частности, биосинтез заменимых аминокислот в организме протекает через стадию образования имина с пиридоксальфосфатом (витамином В6).
Оксимы и финилгидрозоны хорошо кристаллизуются и потому это их свойство часто используется для идентификации и выделения альдегидов и кетонов из смеси с другими веществами.
Задача № 6. Сравните свойства карбонила и гидроксила альдегидов, кетонов, спиртов и карбоксильной группы карбоновых кислот в нуклеофильних реакциях.
Алгоритм решения. Наличие сопряжения в карбоксильной группе карбоновых кислот усложняет реакции присоединения по π-связи и замещение -ОН- группы. В присутствии безводных минеральных кислот карбоновые кислоты протонируются с образованием карбкатионов:
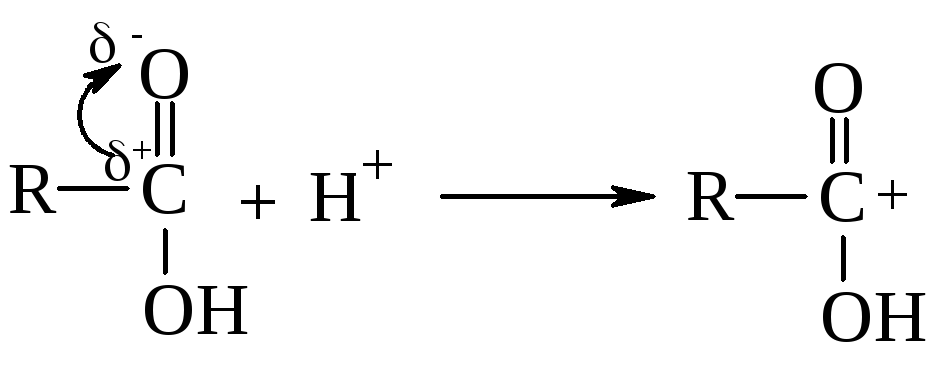
Такие карбкатионы являются промежуточными частицами в некоторых реакциях, например, в реакции образования сложных эфиров:
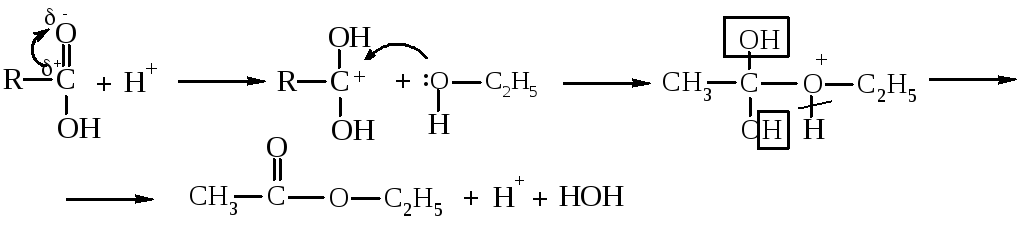
этиловий эфир уксусной кислоты
Замещение гидроксильной группы галогенами под действием сильных галогенирующих агентов - галогенидов фосфора или SOCl2 (хлористый тионил):
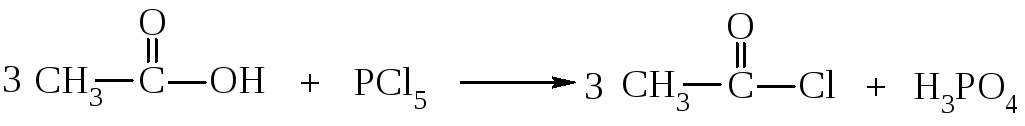
хлористый ацетил
Продукты реакции называют галогенангидридами. Это очень непрочные и очень реакционно способные соединения. Они являются ценными ацилирующими агентами, т.е. используются для введения ацильного радикала в молекулы органических веществ. Ацилирование применяется для защиты аминогруппы во время синтеза пептидов. Ацилирование аминов приводит к образованию амидов, которые являются биологически активными соединениями:

Амид уксусной кислоты
