
- •устойчивости коллоидов.
- •Виды устойчивости растворов (по
- •Коагуляция ‒ …
- •Факторы, вызывающие коагуляцию
- •Факторы, вызывающие коагуляцию
- •При изучении влияния электролитов на коагуляцию следует учитывать:
- •чем выше заряд коагулирующего иона, тем меньше сп и выше γ электролита.
- •Правило Дерягина ‒ Ландау …
- •Факторы, вызывающие коагуляцию
- •Факторы, вызывающие
- •Особые случаи
- •2. Чередование зон коагуляции
- •4. Сенсибилизация …
- •Защитное число …
- •Процесс перехода свежевыпавшего при
- •Кинетика коагуляции
- •Коагуляция по Смолуховскому М. (1906г.)
- •νкоаг.
- •Коагуляция
- •Уравнение Смолуховского …
- •Спасибо за внимание!
Коагуляция по Смолуховскому М. (1906г.) |
21 |
При столкновении 2-х первичных частиц золя |
появляются более крупные – вторичные и т.д. |
Следовательно, коагуляция – реакция II |
порядка и её ν можно описать кинетическим |
уравнением реакции II порядка. |
Недостаток схемы: 1) в дальнейшей хим. |
реакции продукты не участвуют, а коллоидные |
частицы, участвуют, увеличивая свой размер; |
2) все частицы сферической формы и одного |
радиуса. |
νкоаг. |
Скрытая |
|
|
Я в н а я к о а г у л я ц и я |
|||
|
|
Медленная |
|
|
Быстрая |
||
|
коагуляци |
|
|
K |
|
|
N |
|
|
|
|||||
|
я |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S
0 |
A |
Б |
С (эл-та) |
|
ζкрит |
ζ = 0 |
|
22

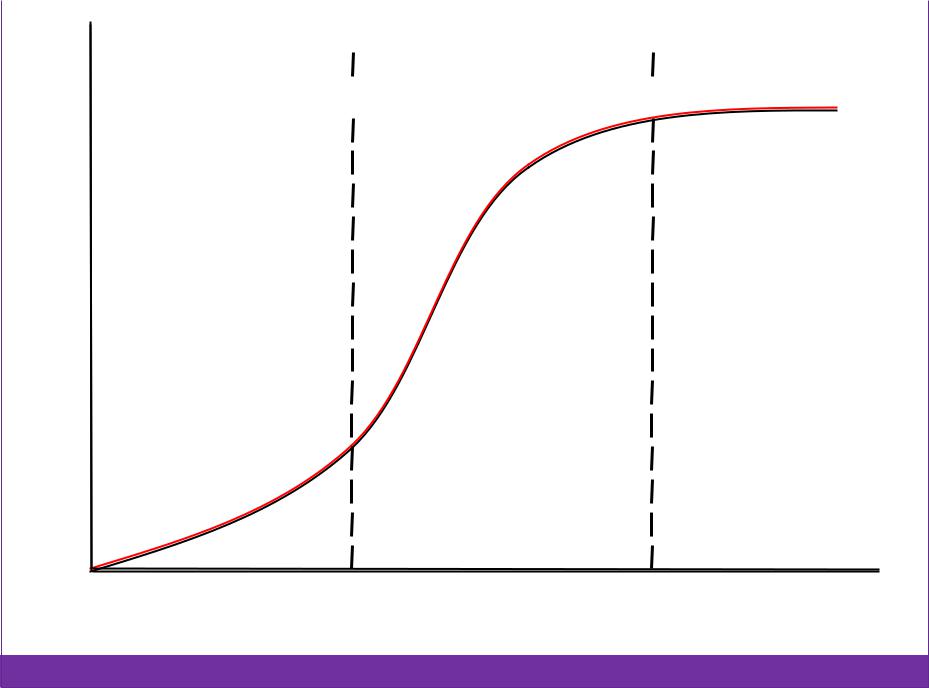
Коагуляция |
23 |
Скрытая включает образование |
вторичных, третичных и т.д. частиц. |
Протекает незаметно и медленно. |
Явная заметна и протекает с разной |
скоростью в зависимости от концентрации Э. |
Отрезок OS – период скрытой |
коагуляции. В точке А достигается сn |
электролита и ζкрит.. |
Отрезок SK – медленная явная |
коагуляция. В точке Б ζ = 0. |
Отрезок KN – быстрая явная коагуляция. |
νкоаг. не зависит от сэлектролита. |
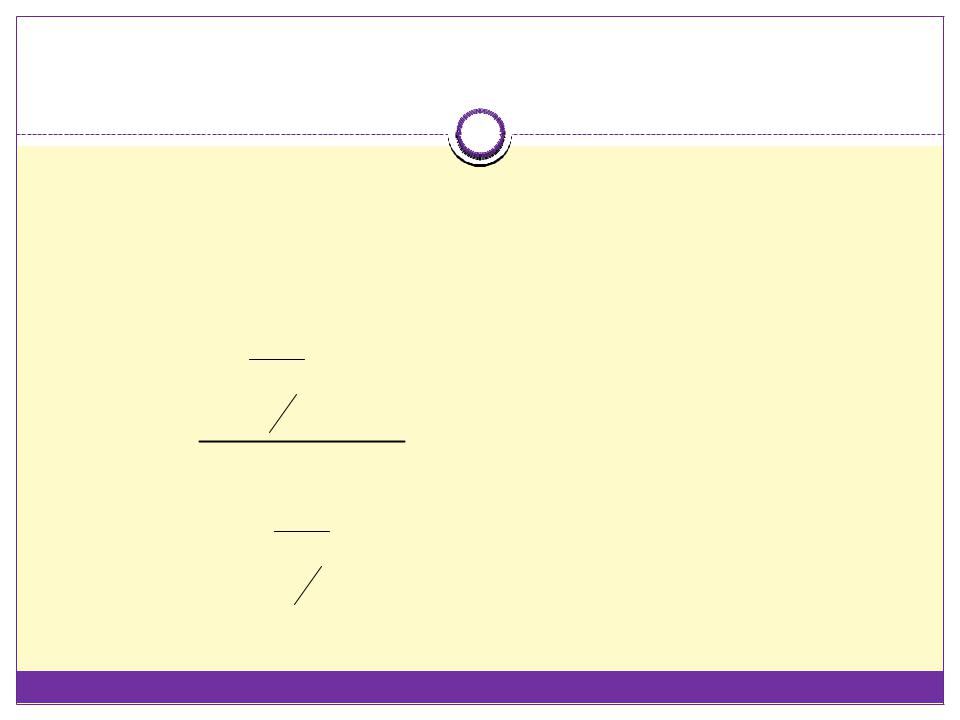
Уравнение Смолуховского … |
||||||||||
|
|
|
|
|
|
|
|
|
|
24 |
… характеризует скорость быстрой |
||||||||||
|
коагуляции. |
|
|
nm – частичная |
||||||
|
|
|
|
|
|
|
|
|
m 1 |
концентрация частиц |
|
|
|
|
|
t |
|
|
кратности m (m – |
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
число частиц из |
|
|
|
|
|
1 |
|
|
которых состоит |
||
|
|
|
|
|
t |
2 |
|
|
||
n |
m |
n |
0 |
|
|
|
|
m 1 |
коагулированная |
|
|
|
|
|
|||||||
|
|
|
|
|
t |
|
частица); |
|||
|
|
|
|
|
|
|
|
|
t – время коагуляции; |
|
|
|
|
|
1 |
t 1 |
|
|
t½ – время, за которое |
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
2 |
число частиц |
|
|
|
|
|
|
|
|
|
|
|
уменьшилось вдвое |
|
|
|
|
|
|
|
|
|
|
против начального; |
|
|
|
|
|
|
|
|
|
|
n |

Спасибо за внимание!
25
