

Х И М И Ч ЕСК О Е РА В Н О В ЕСИ Е И ЕГО
ТЕРМ О Д И Н А М И Ч ЕСК О Е
ОБ О СН О В А Н И Е.
ПРИ Н Ц И П А Д А П ТИ В Н Ы Х П ЕРЕСТРО ЕК
Лекция №4 курса «Общая химия»
Лектор: проф. Иванова Надежда Семёновна

К ритерии равновесия
Для химической реакции общего вида
aA + bB xX + yY
состояние равновесия может быть описано и с точки зрения кинетики и с точки зрения термодинамики. С точки зрения термодинамики макроскопические системы достигают равновесия, когда изменение энергии компенсируется энтропийной составляющей.
2
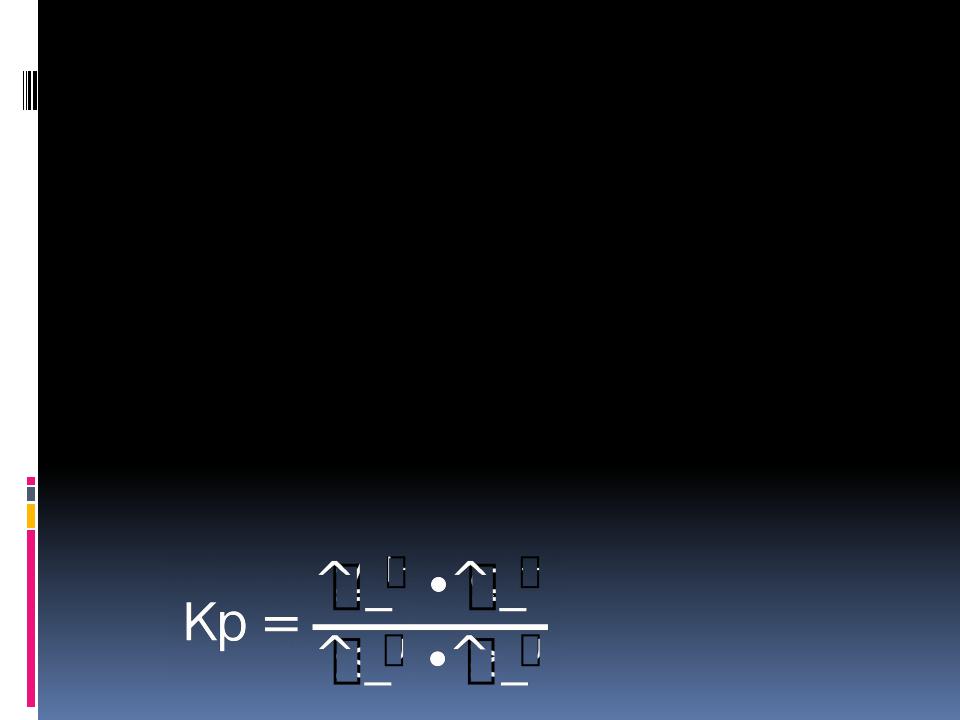
К ритерии равновесия
Для постоянного давления и температуры: H = T S, тогда
G= 0.
Сточки зрения кинетики состояние равновесия характеризуется
величиной константы равновесия:
(при
Т=const)
3
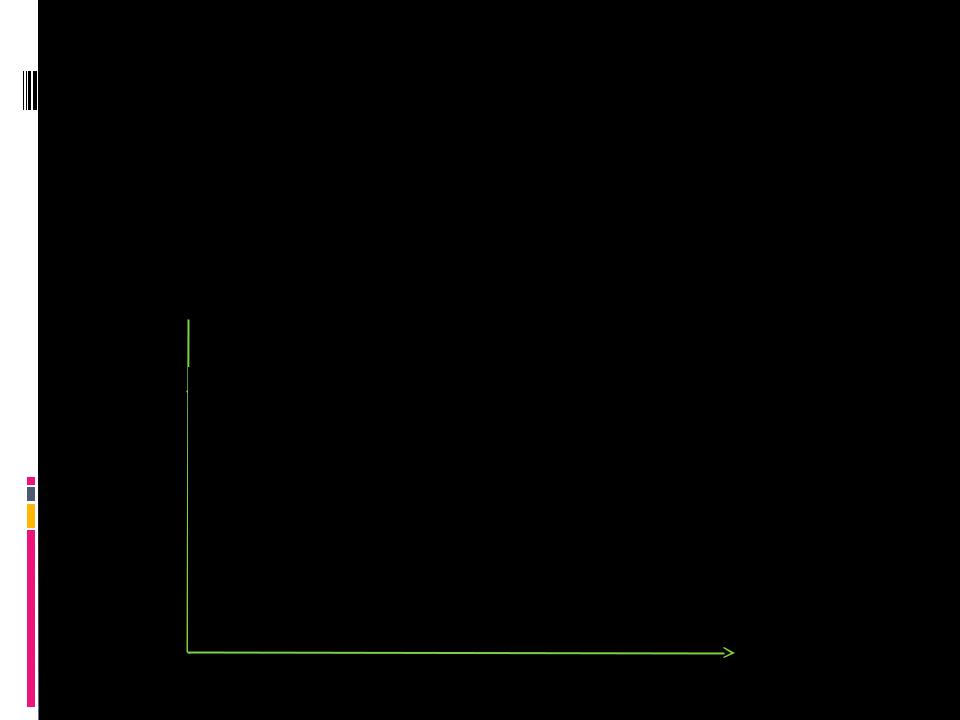
Д остиж ение равновесия в обратим ой реакции
I прямая реакция
II обратная реакция III состояние
III состояние
равновесия
Время
4

Уравнение изотерм ы хим ической реакции
Для процесса в общем виде:
ВположенииG = 0
G =
RTlnKр
Якоб Хендрик Вант-Гофф (1852-1911) 5
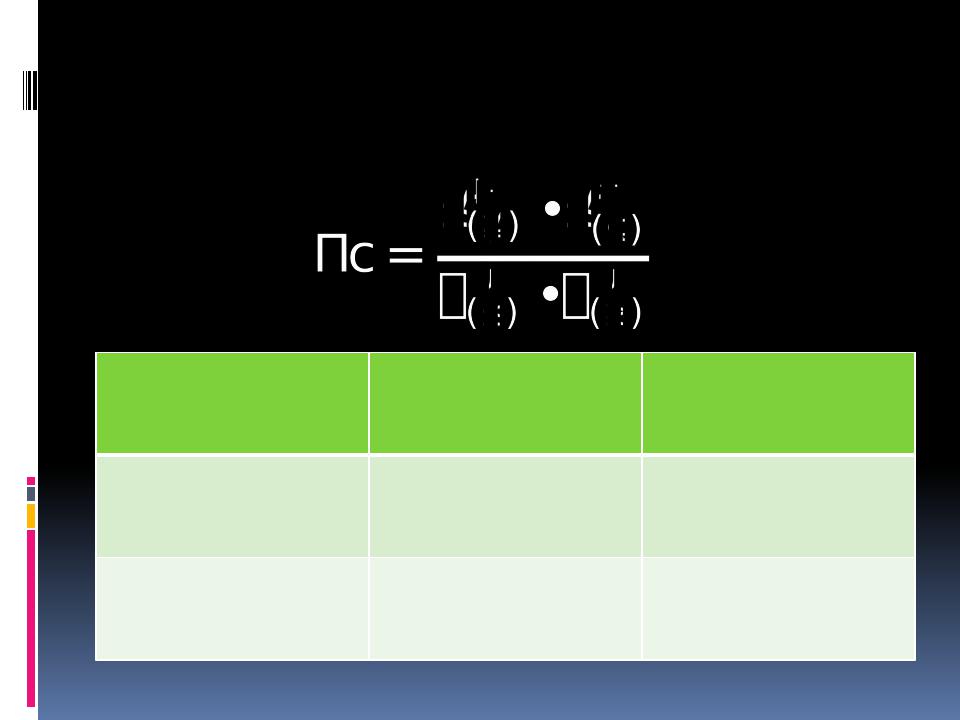
Соотнош ение П с и К р
Пс Кр |
G 0 |
|
Пс Кр |
G 0 |
|
Пс = Кр |
G = 0 |
|
6

П ринцип под виж ного
равновесия
При изменении одного из условий химического равновесия оно смещается в сторону той реакции, которая уменьшает произведённое изменение.
Принцип адаптивных |
|
|
перестроек |
|
|
Любая живая система |
|
|
при воздействии на неё |
Анри-Луи Ле Шателье |
|
перестраивается так, |
(1850-1936) |
7 |
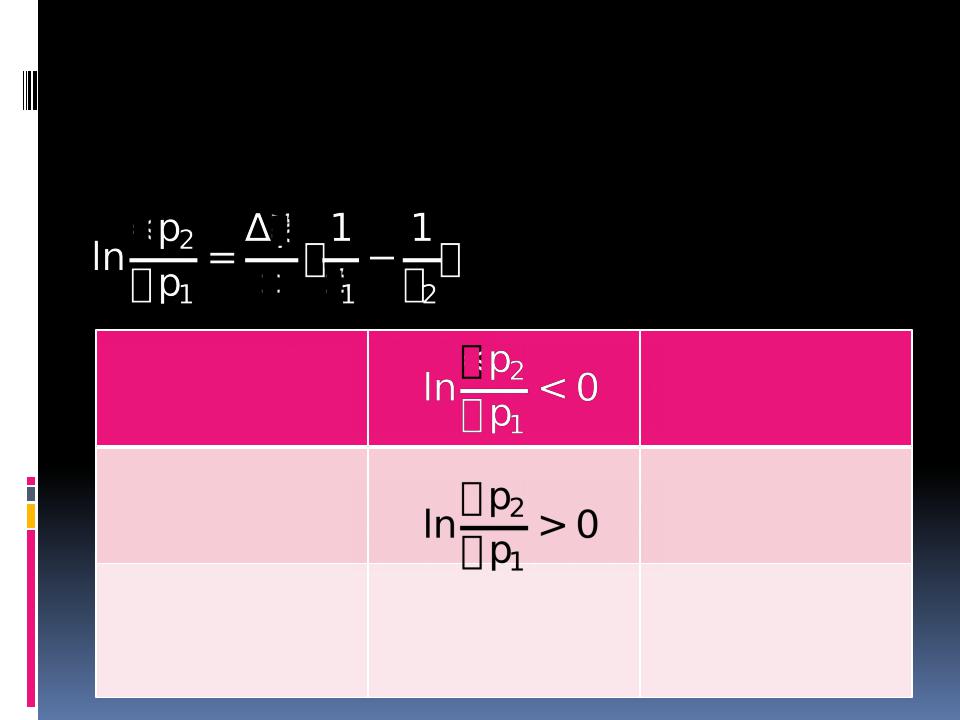
Уравнение изобары хим ической реакции
Ограничение: Т должна быть небольшой.
Н 0 |
|
Н 0 |
|
Н = 0 |
|
8

Влияние д авления на см ещ ение равновесия
n = (x + y) (a + b)
n изменение числа моль газов в реакции
n 0 |
|
n 0 |
|
n = 0 |
|
9

Спасибо за внимание!
И И Д И ТЕ Н А Х У Й !
10
