
- •Протолитическая и электронная теории кислот и оснований. Типы протолитических реакций. Роль гидролиза в
- •Теория Бренстеда Лаури (Б- Л), предложенная в 1923 г., определяет кислоты и основания
- •Кислоты и основания
- •Тогда протолитическое равновесие может быть выражено схемой:
- •Типы кислот и оснований Б-
- •Роль растворителя в протолитических равновесиях
- •Автопротолиз
- •Виды кислотностей
- •Виды кислотностей
- •Типы протолитических
- •Типы протолитических
- •Степень гидролиза и
- •Электронная теория кислот и оснований
- •Спасибо за внимание!
Нет
ХАЛАТА?!
до
свидания!
+ н/б! 1

Протолитическая и электронная теории кислот и оснований. Типы протолитических реакций. Роль гидролиза в биохимических процессах
Лекция №8 курса «Общая химия»
Лектор: проф. Иванова Надежда Семёновна
2

Теория Бренстеда Лаури (Б- Л), предложенная в 1923 г., определяет кислоты и основания по отношению к
одному партнёру Н+. Поэтому кислоты и основания
Йоханнес-Николаус называются протолитами;
Брёнстед
обратимые(1879-1947)реакции, в которых осуществляется перенос протонов,
протолитическими равновесиями, а
теория Б-Л протолитической |
3 |

Кислоты и основания |
|
||||
|
|
Б-Л |
|
|
|
Кислота протон-донорное вещество. |
|
||||
Основание протон-акцепторное |
|
||||
вещество. |
|
|
|
|
|
Из этого можно записать соотношение: |
|
||||
|
Кислот |
Основан |
Н |
|
|
|
а |
ие |
|
+ |
|
Кислоту и основание, связанные |
|
||||
приведённым соотношением, называют |
|
||||
|
|
Сопр. |
|
|
|
сопряжённой кислотно основной |
|
||||
парой: |
Кисло |
основан |
Н+ |
|
|
та |
|
||||
Основан |
ие |
|
Сопр. |
|
|
Н |
|
|
|||
|
ие |
+ |
кислот |
|
|
|
|
|
а |
4 |
|
|
|
|
|
||
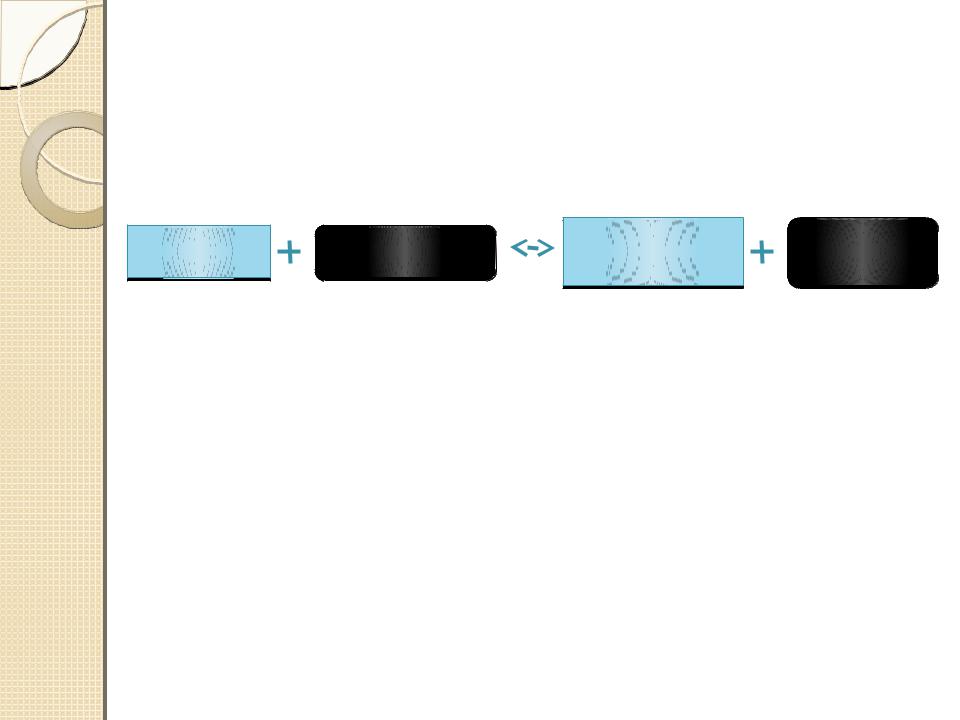
Тогда протолитическое равновесие может быть выражено схемой:
Кислот |
Основани |
Сопр. |
Сопр. |
||
основани |
кислота |
||||
а 1 |
е 2 |
||||
е 1 |
|
2 |
|||
Направление протолитического |
|
||||
равновесия устанавливается в
результате конкуренции за Н+ между основаниями сопряжённых кислотно- основных пар и всегда смещается в сторону более слабой кислоты.
5
Типы кислот и оснований Б-
Л
НейтралАнионное.кислоснованта.
СН3СООН
СН3СОО
КатионнаяНейтралкислота.основан.
NH4+
NH3
Анионнаяионноекислотаоснован. HSO4
SO42
6

Роль растворителя в протолитических равновесиях
В растворе вещество не может реагировать как кислота, если нет основания, роль которого может выполнять растворитель (Н2О).
кисло |
основан |
СОО- + Н3О+ |
СН3СООН + Н2О СН3 |
||
та |
ие |
|
NHоснован+ H кислоO NH + + OH- ие3 2та 4
7

Автопротолиз
Из этого следует, что Н2О является амфолитом, а процесс:
Н2О+ Н2О Н3О+ + ОН-
Осн. |
Кисл. |
С. кисл. |
С. |
1 |
2 |
1 |
осн.2 |
называется автопротолизом,
характеризующимся const (Kw) / ионным произведением воды.
Kw = OH-  H+ = 10-14
H+ = 10-14
8

рН …
… отрицательный десятичный логарифм концентрации ионов водорода pH = lg H+
Нейтральна я среда
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 12 |
13 |
14 |
|
Сильнокис |
Слабокислотна |
|
Слабощелочна |
Сильнощело |
||||||||||
|
лотная |
|
|
я среда |
|
|
|
я среда |
|
чная среда |
||||
|
среда |
|
|
|
|
|
|
|
|
|
|
|
|
|
9

 Виды кислотностей
Виды кислотностей
АК молярная концентрация эквивалентов свободных ионов Н+
в растворе. |
АК= 10-рН |
моль дм-3 ТК молярная концентрация
эквивалентов всех кислот в
10

 Виды кислотностей
Виды кислотностей
ПК молярная концентрация эквивалентов недиссоциированных
молекул кислоты. |
ПК = ТК |
АК ОК сумма титруемой
кислотности и молярной концентрации эквивалентов
кислот Б Л, неопределяемых |
11 |
